

用一句话形容mRNA疫苗,应当是临危受命,一炮而红。
当大流行在全世界肆虐之时,辉瑞/BioNTech和Moderna在不到一年时间之内便各自开发了出高效的mRNA疫苗,于2021年爆卖587亿美元,可谓名利双收。
资本应声而动,2021年全球mRNA领域的总融资额超过20亿美元,中国公司的融资额更是高达15亿美元,占比超过七成。
其中尤以艾博生物最为抢眼,C轮获7亿美元融资,刷新了中国生物药企IPO前单笔融资纪录。
不仅如此,公司在当年先后完成B、C、C+三轮融资,总融资额突破10亿美元,投后估值接近190亿元。
如此大力押注,换来的结果却堪称惨淡:尚无一款本土新冠mRNA疫苗取得亮眼成绩。
实际上,作为国产mRNA“独苗”,石药集团的SYS6006今年三月份才获批,五月份才接种全国首针,赶了个晚集。
被寄予厚望的Biotech们更是“全军覆没”,至今没有mRNA疫苗在国内获批上市,仅艾博生物和斯微生物两家分别拿到印度尼西亚和老挝的紧急使用授权。
如果说管线进展不及预期仅仅代表了公司在技术探索上的挫折,那么当停产、转型的消息传来,情况可能要比想象中的更为糟糕。
缺少积累和沉淀的本土mRNA药企们,在经过一波汹涌的“催熟”浪潮后,正在面临漫长而艰难的冬天。
 多事之秋
多事之秋
业内大名鼎鼎的斯微生物,最近正处在风口浪尖之上。
8月24日,公司官方微信公众号发布一则公告表示,将提供CDMO服务。
而就在上个月,公司位于上海的mRNA疫苗生产基地天慈工厂暂停试运行,原因是“外部客观环境发生重大变化,且考虑到天慈工厂近期无新冠疫苗生产需求”。
资料显示,包括天慈工厂在内,斯微生物拥有两大mRNA疫苗生产基地共计三个车间,年产能达4-5亿剂。
上述3个车间均于2021年建成并投入使用,而能在短期内支撑起如此庞大规模的,无疑只有新冠mRNA疫苗的需求。
然而,相关产品迟迟无法获批上市,给公司雄心勃勃的扩产计划浇了一盆冷水。
作为国内第二款进入临床阶段的国产mRNA新冠疫苗,斯微生物的SW-BIC-213于2021年1月获得临床试验批件,但至今仍没有获批上市,公司曾向药监局递交国内紧急使用授权(EUA)申请,未有下文。
同样受挫的还有艾博生物,该公司与沃森生物共同开发的mRNA疫苗ARCoV,早在2020年6月便获批临床试验,早于国内同行整整半年,但直至现在唯一的战果是在2022年10月获得的印尼的紧急用途许可(EUA)。
根据公开信息,艾博生物成立于2019年,创始人英博曾任Moderna项目负责人,直到2020年1月,艾博生物还只是一个8个人组成的小公司。
然而,在疫情的催动下,公司转眼便成为备受追捧的明日之星,不到两年间共融资超过11亿美元,吸引包括淡马锡、高瓴、礼来亚洲、博裕、启明、五源在内的众多知名机构。

当然,眼前的挫折对于斯微、艾博这样的头部Biotech来讲仍在承受范围之内,毕竟前者刚刚在5月完成了数亿元的Pre-D轮融资;后者虽然自2022年以来未有新一轮融资,但丰厚的家底依旧足以保证公司未来几年不必为钱担忧。
但对于那些处在腰部的mRNA初创来说,决定其生死存亡的关键时点已经到来:已经有mRNA企业选择“卖身”求生。
6月27日,科创板上市公司百克生物发布公告,称将按照一次定价、分期实施的原则,拟分步对mRNA公司传信生物进行增资及股权收购,并最终持有其100%股权。
据悉,被收购的传信生物成立于2021年4月,致力于RNA药物的商业化开发,正在开发新型传染病和肿瘤mRNA疫苗。其创始人陈建新曾主导全球首个siRNA药物Patisiran的关键递送技术MC3的开发,也是全球知名的纳米脂颗粒(Lipid Nano-Particle,LNP)递送技术公司Acuitas Therapeutics的核心创始人之一。
2021年6月和2022年1月,公司先后完成两轮融资,仅天使轮就获得一亿元人民币资金,投资机构包括元生创投、华盖资本、建银国际、洪泰基金等。
具体交易细节中,百克生物表示会先出资1.5亿元收购传信生物17.64%的股权,此后的增资及完全收购则需要以传信生物mRNA 疫苗项目达成多个目标为条件,且还涉及对赌协议。
换言之,如果传信生物的进度不及预期,百克生物有权顺延、变更、中止甚至终止交易,透露出满满的不信任之感。
但是,对于账上资金可能不足以支撑一年运营的传信生物来说,似乎没有可以对上述苛刻条件说不的底气。
 潮涨潮落
潮涨潮落
mRNA技术能够站在聚光灯下,并一度成为生物医药最炙手可热的领域,离不开新冠疫情的催化。
毕竟在此之前,全球尚没有一款上市的mRNA疗法。
实际上,科学家们对mRNA的研究已经有数十年之久,早在上世纪80年代,科学家便开始研究如何将mRNA分子作为治疗用途,但其安全性和生产可行性长久以来备受争议。
mRNA即信使核糖核酸,作为DNA转化为蛋白质的中间体,mRNA类似于说明书,能够指导自身细胞生产出特定的蛋白。利用这一特性,mRNA疫苗将人为编辑过的mRNA片段输入人体细胞,让细胞产生出特定蛋白,以此来治疗疾病。
听起来非常简单易懂,但在实际操作中困难重重,最大的问题是如何使mRNA片段高效、安全地进入到细胞内。
由于mRNA固有的免疫原性、对酶降解的易感性以及其与细胞膜的排斥反应,一个合适的“运输工具”必不可少,于是针对递送系统的研发成为mRNA疗法的关键所在。
到了本世纪10年代初,研究人员在开发基于脂质纳米粒(LNP)递送系统的mRNA疫苗上取得突破,包括诺华在内的多家大型药企宣布进军mRNA,Moderna也在那时成立。
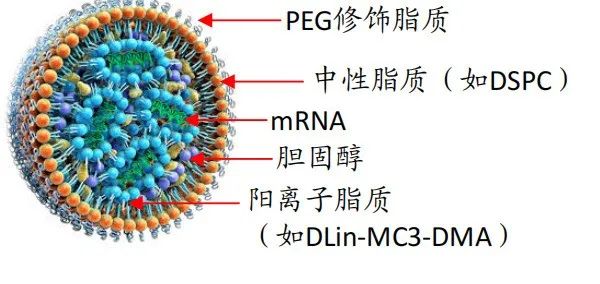
图:LNP递送载体结构
彼时mRNA疫苗虽然已经展现了巨大的应用潜力,但实际价值究竟如何尚没有定论,直到新冠的爆发给了相关公司证明自己的机会。
此后的事情我们早已耳熟能详:当新冠席卷全球之际,Moderna和BioNTech只用了40天时间便将项目推进至临床阶段,随后辉瑞/BioNTech的mRNA疫苗于2020年12月获批上市,成为全球首款新冠疫苗产品,整个开发周期仅用了8个月。
BioNTech和Moderna这两位后起之秀,击败了包括GSK、默沙东、赛诺菲等传统疫苗巨头,两款mRNA疫苗于2021年分别创下404亿美元和176.75亿美元的营收,成为全球销售额第一和第三的药物。
火爆程度甚至引得埃隆·马斯克、比尔·盖茨的关注,在媒体面前,马斯克对这项技术的赞赏溢于言表:“医学的未来是mRNA,基本上你可以使用mRNA治愈一切。它就像一个电脑程序,你可以对其进行编程以执行所需的任何操作。”
回头来看,如此奇迹正是得益于国外几十年来在mRNA和LNP的大量基础研究和测试,才使得针对Covid-19的mRNA疫苗开发如此顺利。
而这波来自大洋彼岸的风潮,自然也影响了中国,一时间众多本土企业的大额融资消息不断传来。
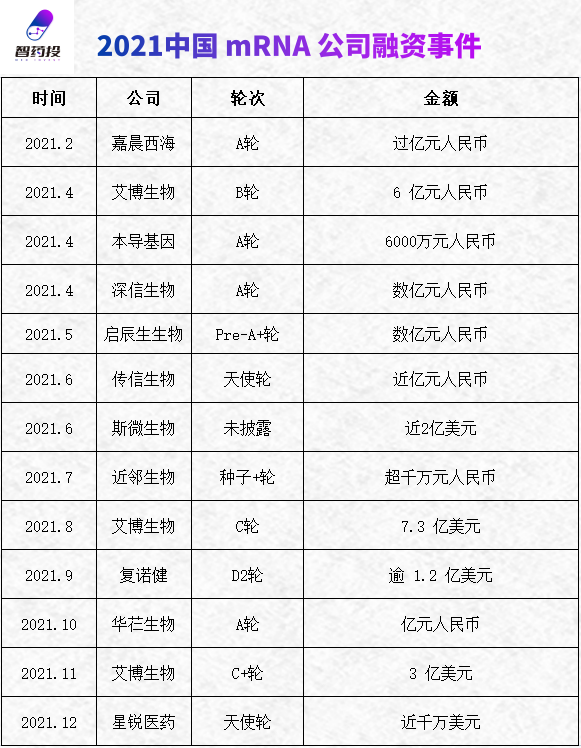
得到资本大力支持的mRNA企业,在合作上也备受药企青睐:仅2021年7月,嘉晨西海便先后与天境生物、康泰生物、君实生物签署合作协议,共同开发mRNA药物。
再加上此前与欧林生物的合作,嘉晨西海先后与四家上市公司达成合作,被戏称为“mRNA版海王”,折射出行业的火热。
有BioNTech和Moderna珠玉在前,mRNA疫苗被业内人士寄予厚望,赋予了改变中国落后疫苗行业的使命。
遗憾的是,与国外领先企业长达十余年的坚守相比,大多数中国mRNA企业还相对青涩,技术路线上也存在同质化现象。
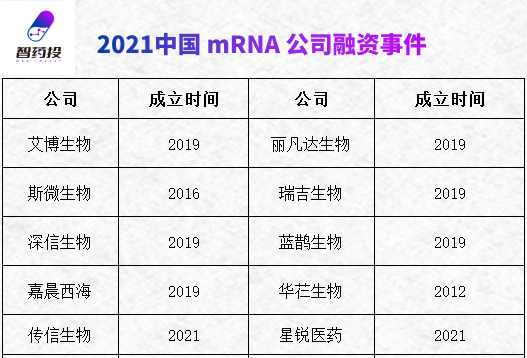
这当然也引发了部分行业人士的质疑,“资本催熟”、“跟风抄袭”等指责声音接连不断。
而相关临床试验一再延后、多家上市公司解除合作等情况的出现,似乎在一定程度上坐实了上述观点。
进入2022年,此前一股脑的看好逐渐演变为深刻的分歧:当券商分析师认为mRNA技术将进入黄金十年的同时,一级市场的风险资本却在慢慢撤退,融资额经历断崖式下跌,许多相关企业的融资至今仍停留在2021年。
 押注下一个战场
押注下一个战场
就在斯微生物关停工厂的同一时间,公司注册肿瘤新抗原mRNA疫苗治疗晚期恶性肿瘤的IIT临床研究的消息传出。
资料显示,该研究是一项开放性、单臂、剂量递增的研究,旨在评价mRNA肿瘤疫苗与信迪利单抗联合治疗中晚期恶性实体瘤的安全性和有效性,计划入组20例PD-1/PD-L1抗体耐药的患者,预计2025年底初步完成。
无独有偶,艾博生物也于今年6月表示,公司首款肿瘤治疗领域mRNA在研药物ABO2011注射液的新药临床试验申请获得国家药品监督管理局批准。
在此之前,由新合生物开发的XH101注射液IND申请获得CDE受理,这是国内首款获得IND受理的mRNA肿瘤新抗原疫苗。
实际上,在新冠之前,mRNA疫苗的首要目标便是癌症,即使到了新冠疫苗研发火热的2021年,全球仍有超过50%的mRNA临床试验集中在了肿瘤治疗上。
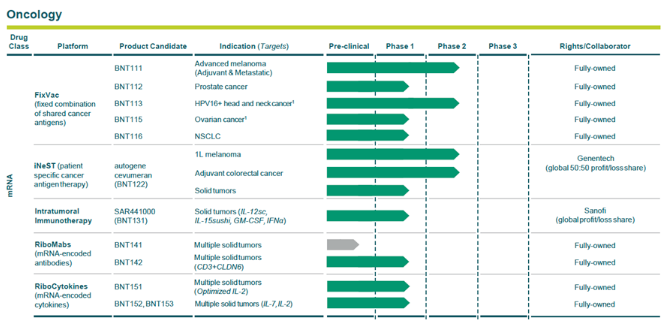
图:BioNTech针对癌症的mRNA管线
此外,研究及临床试验显示,mRNA疫苗与其他抗肿瘤疗法(如PD-1抗体、CAR-T等)联用,也表现出不俗的疗效。
今年2月,默沙东/Moderna宣布,在研mRNA癌症疫苗mRNA-4157/V940联合帕博利珠单抗组合疗法获美国食品药品监督管理局(FDA)授予突破性疗法认定,用于高危黑色素瘤患者接受完全切除术后的辅助治疗。
此前BioNTech 在美国癌症研究协会(AACR)2022 年会上公布的数据显示,其mRNA疫苗CARVac与CAR-T联合治疗 Claudin6阳性实体瘤(睾丸癌、卵巢癌等)的1/2期临床效果良好,在14名可评估疗效的患者中,客观缓解率为43%,疾病控制率为86%。
当大流行渐行渐远,被扰乱的节奏重回正轨,输掉了新冠研发竞赛的国内mRNA初创企业,正在寻找下一个战场。
只是,与之前的极限竞速相比,新赛道需要更多的坚持与耐心。
BioNTech创始人在接受媒体采访时表示,他们对未来几年的癌症疫苗充满乐观,预计mRNA癌症疫苗会在2030年之前上市使用。
而对于国内企业来说,要将mRNA癌症疫苗推进至Ⅲ期乃至获批上市,保守估计也要5-10年时间。
当时间维度被拉长,开源节流打持久战已经成为业内共识,这也解释了为什么刚刚完成融资,理应“不差钱”的斯微生物仍选择暂停工厂运营并开拓CDMO业务。
尽管如此,可以确定的是,疫情催化的本土mRNA 公司,在短暂的火热之后,迎来的将是更加漫长的考验,残酷的出清才刚刚刚开始。
—The End—
推荐阅读






 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


