今天我们介绍由魏茨曼科学研究所生物分子科学系的Ariel Tennenhouse发表在《Nature Biomedical Engineering》上的工作。该工作提出了一种新的计算方法CUMAb,它可以在成千上万个人源框架上系统地嫁接动物源抗体的互补确定区,从而产生人源化抗体。该方法利用Rosetta进行原子模拟,根据能量和结构完整性选择设计。用该方法人源化的5个抗体与亲本动物抗体具有类似的亲和力,有些设计的稳定性还有明显提高。结果表明,与同源性最高的框架相比,非同源框架常常是首选,此外,许多仅在几十个突变位点不同、使用不同人源框架的CUMAb设计具有等效的功能。

背景介绍
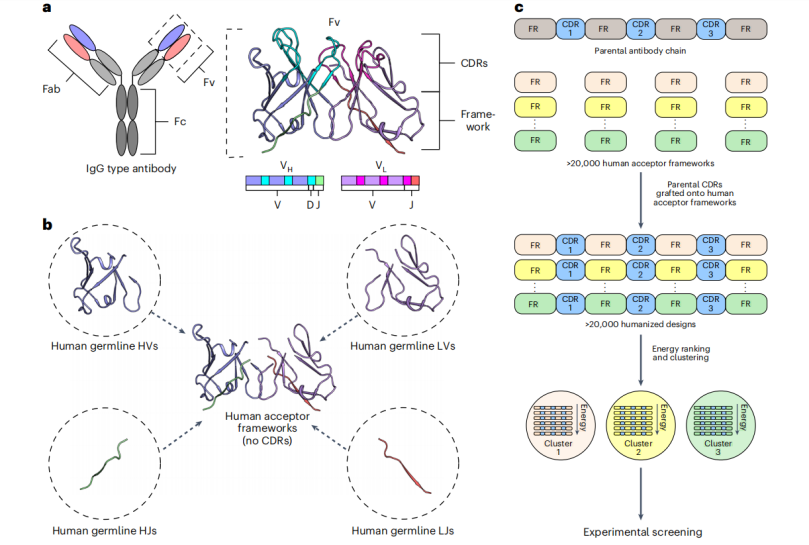
图1:利用CUMAb进行基于能量的抗体人源化的关键步骤
抗体是目前最大的基于蛋白质的治疗药物,其中1/3来源于动物并需要人源化以用于临床(图1)。抗体人源化对招募免疫系统、增加血清半衰期以及减少免疫原性至关重要。目前的主流人源化策略是将动物抗体的CDR移植到人源化框架上,通常导致Fv与人源谱系具有80%以上的同一性。但是人源化经常导致抗体的表达量、稳定性和亲和力大幅下降,需要长时间的“回归突变”来恢复亲和力和稳定性。这主要源于动物CDR与人源框架之间的结构和能量不匹配。我们开发了一种新的计算人源化抗体设计方法CUMAb,可以对每个抗体自动设计和评价2万多个人源化构型,仅基于能量进行排序。我们证实了该方法可以设计出与亲本抗体媲美甚至优于亲本抗体的人源化抗体,而无需进行回归设计。这种基于能量的人源化方法可能提供了一种不同并且更有效的策略。
实验结果
基于能量的人源化抗体的系统排名
研究者描述了一种对人源化Fv设计进行建模和能量排序的通用计算流程。首先替换动物Fv的所有框架区为兼容的人源化框架,只保留父代CDR(图1)。组合所有人源光重链的V和J基因段,可以产生数万个独特的框架(图1b)。基于对代表性Fv结构的视觉检查定义CDR区域。将鼠源CDR序列与人源框架重新组合,生成人源化序列(图1c)。使用Rosetta进行全原子计算对每个人源化序列进行建模。如果有抗原-抗体复合物的实验结构,则抗原结合区保持不变。每个模型使用Rosetta能量函数进行评分,排除CDR背骨偏离父代构象超过0.5埃的设计。选取评分最高的设计进行实验测试。这种方法与传统同源移植方法不同,不依赖动物和人框架之间的同源性。CUMAb能够在几个小时内对2万个人源化构型进行设计和评估。
一次性人源化匹配多个框架上的亲代抗体亲和力
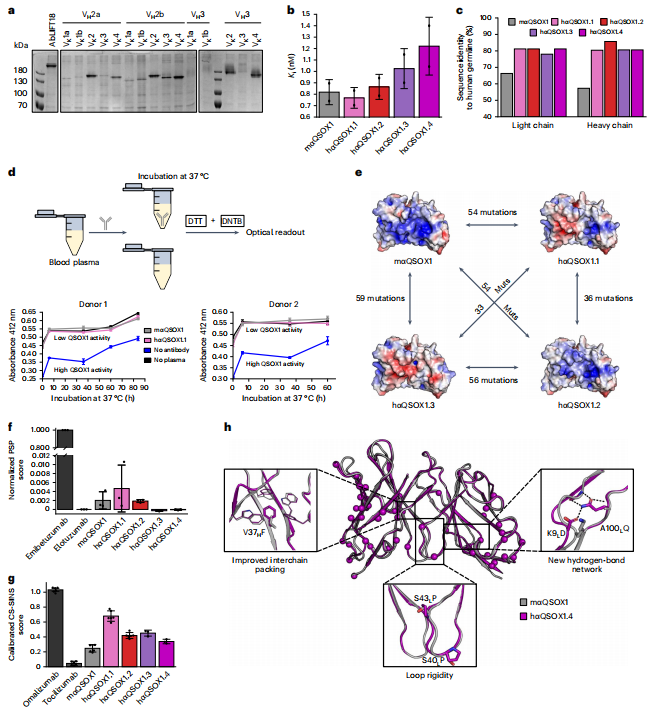
图2:抗QSOX1抗体的人源化
研究者选择小鼠单克隆抗体mAb492.1(mαQSOX1)作为人源化目标,该抗体能抑制人QSOX1的酶活性。将VARIABLE区与人IgG1恒定区组合表达导致完全丧失表达(图2)。之前使用AbLIFT方法部分人源化该抗体,光重链同源性分别为66%和57%。本研究直接对mαQSOX1使用CUMAb人源化。测试了5个光链和3个重链的所有组合,有12对组合的表达水平良好。2个高表达有功能设计(hαQSOX1.1和hαQSOX1.2)表现出与父代抗体相似的抑制常数(图2b)。另外测试了2个设计(hαQSOX1.3和hαQSOX1.4),也显示出类似的抑制活性。4个设计的人源化程度高(图2c),表观熔点温度均超过70℃。hαQSOX1.1在人浆中60小时内仍近乎完全抗QSOX1(图2d),保留了父代抗体的功能和稳定性。4个设计表面电荷不同(图2e),显示出对非特异性结合和自交联的改善(图2f, 2g)。hαQSOX1.4与父代抗体的结晶结构验证了CUMAb的精准性(图2h)。
基于Fv模型结构的人源化
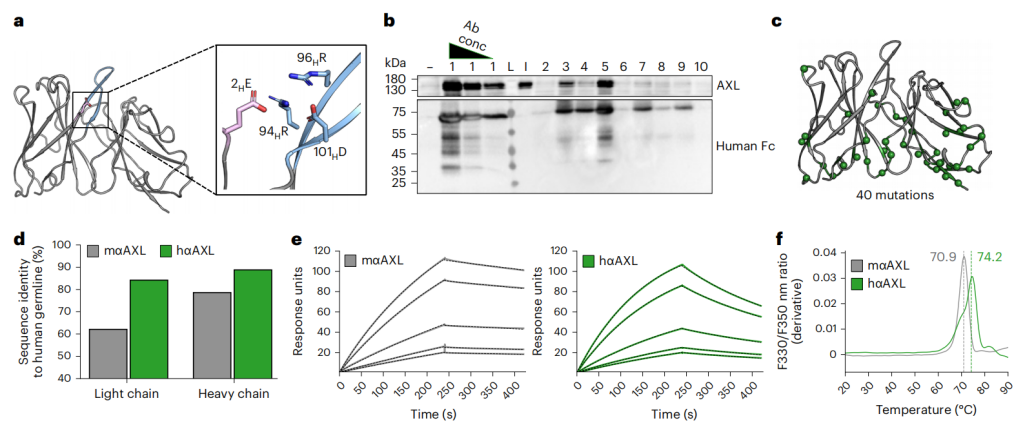
图3:基于AlphaFold模型结构的抗人AXL抗体的人源化
近年来抗体Fv结构预测已经达到近原子级精确度,我们测试了whether CUMAb可以在没有实验确定的Fv结构的情况下进行抗体人源化。我们预测了小鼠抗AXL抗体的Fv结构,使用CUMAb设计了10个人源化版本(图3)。通过表达筛选找到1个设计hαAXL表达量高而且亲和力接近亲本抗体。
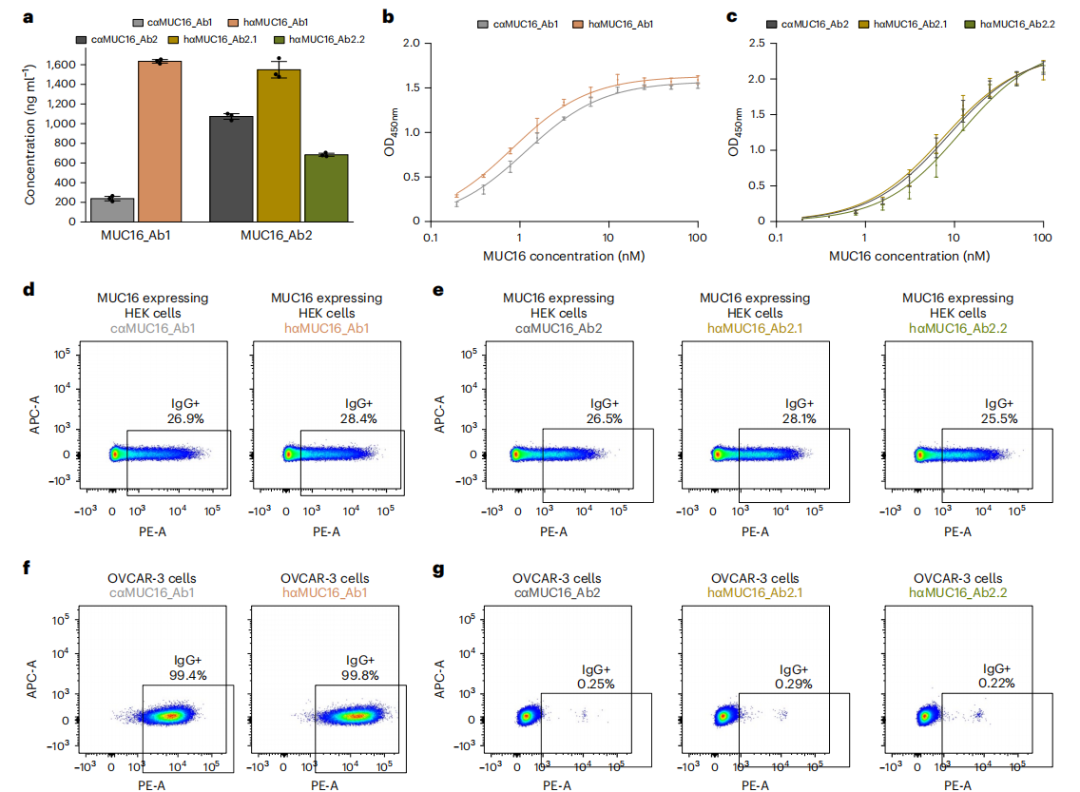
图4:基于模型结构的两种anti-mucin16抗体的人源化
我们又针对两种抗MUC16小鼠抗体预测Fv结构并设计人源化版本。人源化设计hαMUC16_Ab1表达量比嵌合抗体提高了7倍,而hαMUC16_Ab2.1和hαMUC16_Ab2.2表达接近嵌合抗体(图4)。三个人源化版本亲和力接近对应的嵌合抗体。结果表明尽管使用预测的Fv结构存在不确定性,CUMAb仍可以快速设计出高表达量、高亲和力的人源化抗体。
通过特异性确定残基嫁接增加人源性
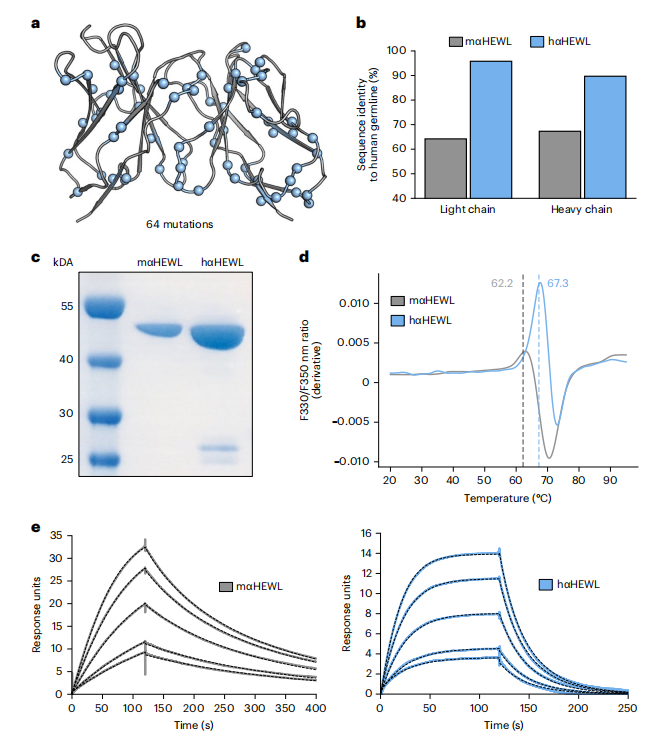
图5:anti-HEWL抗体的SDR移植
为进一步提高人源化抗体的人源性,我们将CUMAb energy-based方法应用于仅移植抗原结合关键位点(SDR)的策略。我们对小鼠抗HEWL抗体D44.1应用SDR移植。实验表明设计1(hαHEWL)与亲本抗体相比,表达量更高、热稳定性提高了5°C(图5)。亲和力方面,hαHEWL的亲和力为44nM,略低于亲本的6.5nM。结果表明,SDR移植策略可以进一步提高抗体的人源性,但可能以亲和力略有降低为代价。
基于能量的人源化利用了非同源框架
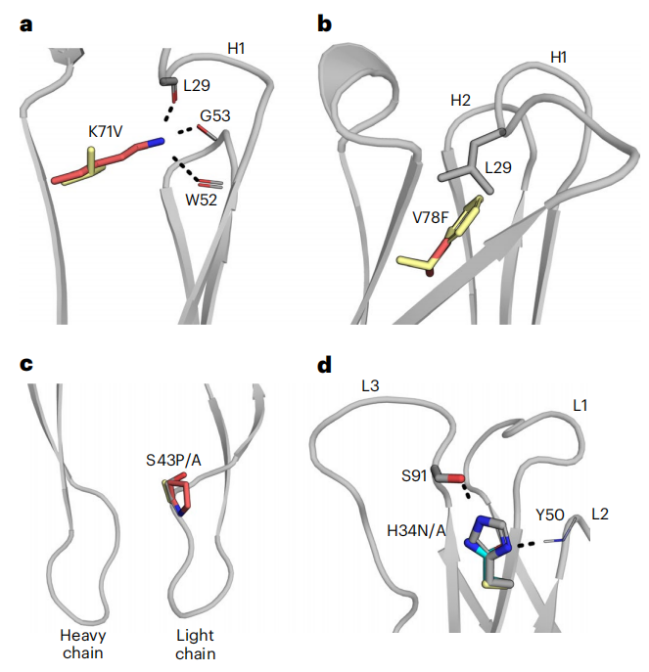
图6:非同源框架成功人源化的结构决定因素
与传统人源化策略不同,CUMAb采用基于能量的策略而非序列同源性来选择人源化框架。我们分析了5个案例发现,大多数表现最好的设计并非来源于与亲本抗体序列最接近的人源区段。这说明与亲本区段同源性高的人源框架不一定能重建亲本抗体的稳定性和功能。成功设计常保留亲本抗体关键的氢键网络和其他相互作用(图6),而传统同源性高的人源化设计则破坏了这些相互作用从而降低了抗体的稳定性和活性。
讨论
与大多数传统人源化策略不同,CUMAb不仅使用与亲本抗体同源性最高的几个框架,而是评估了全部可能的人源框架组合(每个链>2万种)。即使同一亚组内基因具同源性,关键位点突变也可能稳定特定CDR。结构分析表明,低能量设计保留了框架-CDR关键相互作用,而基于同源性的人源化可能破坏这些相互作用。因此,从大量可能框架中评估能量可以比仅考虑同源性更可能保留亲和力,并提高稳定性和表达量。这种一步法人源化无需回突变,可以广泛自动应用于任何动物抗体。
参考资料
Tennenhouse, A., Khmelnitsky, L., Khalaila, R. et al. Computational optimization of antibody humanness and stability by systematic energy-based ranking. Nat. Biomed. Eng (2023).
https://doi.org/10.1038/s41551-023-01079-1
代码
https://github.com/Fleishman-Lab/CUMAb



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


