2022年度诺贝尔医学或生理学奖由Weissman和Karikó共享,以表彰其在mRNA疫苗领域的贡献。《新英格兰医学杂志》(NEJM)曾发表文章,详细介绍Drew Weissman和Dr. Katalin Karikó博士的伟大贡献。
 感恩mRNA疫苗In Gratitude for mRNA VaccinesStuart LMN Engl J Med 2021; 385:1436-1438
感恩mRNA疫苗In Gratitude for mRNA VaccinesStuart LMN Engl J Med 2021; 385:1436-1438
制造疫苗的工作常被说成吃力不讨好。用世界上最伟大的公共卫生医师之一Bill Foege的话来说,就是:“没有人会因为你把他从不知道自己会得的疾病中救出而感谢你。”
但公共卫生医师认为疫苗投资回报极高,因为疫苗可预防死亡和残疾,尤其是为儿童接种疫苗。那么,为什么我们没有为更多可通过疫苗预防的疾病制造出疫苗呢?原因是疫苗必须效力高且安全性好,只有这样,用于健康人才是合理的,而这使得疫苗研发过程漫长而艰难。
2020年之前,疫苗从最初设想到获得许可的平均时间是10~15年,最短时间是4年(腮腺炎疫苗)。因此,在11个月内研发出COVID-19疫苗是一项非凡壮举,而使其成为可能的是对新疫苗平台(最突出的是mRNA)进行的多年基础研究。其中,2021年拉斯克临床医学研究奖获得者Drew Weissman和Dr. Katalin Karikó博士的贡献尤为重要。
核酸疫苗背后的原理根植于沃森和克里克的中心法则,即DNA转录成mRNA,mRNA再翻译成蛋白质。近30年前,研究表明将DNA或mRNA引入细胞或任何活体都将表达由核酸序列决定的蛋白质。此后不久,在外源性DNA表达的蛋白质被证明可诱导保护性免疫应答之后,核酸疫苗概念得到了验证。然而,DNA疫苗真实世界应用受到了限制,最初是因为与DNA整合入人基因组相关的安全问题,后来是因为难以扩大高效递送DNA到细胞核内的规模。
相比之下,mRNA虽然易发生水解,但似乎更易操作,因为mRNA在细胞质内发挥功能,因而无须将核酸递送到细胞核内。而Weissman和Karikó数十年的基础研究,包括最初在他们自己实验室的研究和后来授权给两家生物技术公司(Moderna和BioNTech)之后的研究,才让mRNA疫苗成真。二人取得成功的关键是什么?
他们克服了几个障碍。mRNA可被先天免疫系统模式识别受体(图1)识别,包括toll样受体家族成员(TLR3和TLR7/8,分别感知双链RNA和单链RNA)和维甲酸诱导基因I蛋白(RIG-I)通路,进而诱导炎症反应和细胞死亡(RIG-I是胞质模式识别受体,可识别短双链RNA并激活Ⅰ型干扰素,从而激活适应性免疫系统)。因此,向动物体内注射mRNA会导致休克,这提示为了避免不可接受的副作用,可用于人体的mRNA剂量可能有限。
为探索减轻炎症的方法,Weissman和Karikó开始了解模式识别受体区分病原体来源RNA和自身RNA的方式。他们观察到许多细胞内RNA(例如丰富的核糖体RNA)经过高度修饰,并推测这些修饰可使自身RNA逃逸免疫识别。
一个关键突破是Weissman和Karikó证明用假尿苷代替尿苷修饰mRNA可减弱免疫激活能力,但同时保留编码蛋白质能力。这一修饰使蛋白质生成增多,可达到未经修饰mRNA的1,000倍,原因是经过修饰的mRNA可逃逸蛋白激酶R识别(蛋白激酶R是识别RNA、然后将翻译起始因子eIF-2α磷酸化和激活、进而关闭蛋白质翻译的传感器)。经过假尿苷修饰的mRNA是Moderna和辉瑞-BioNTech所研发并已获得许可的mRNA疫苗主干。
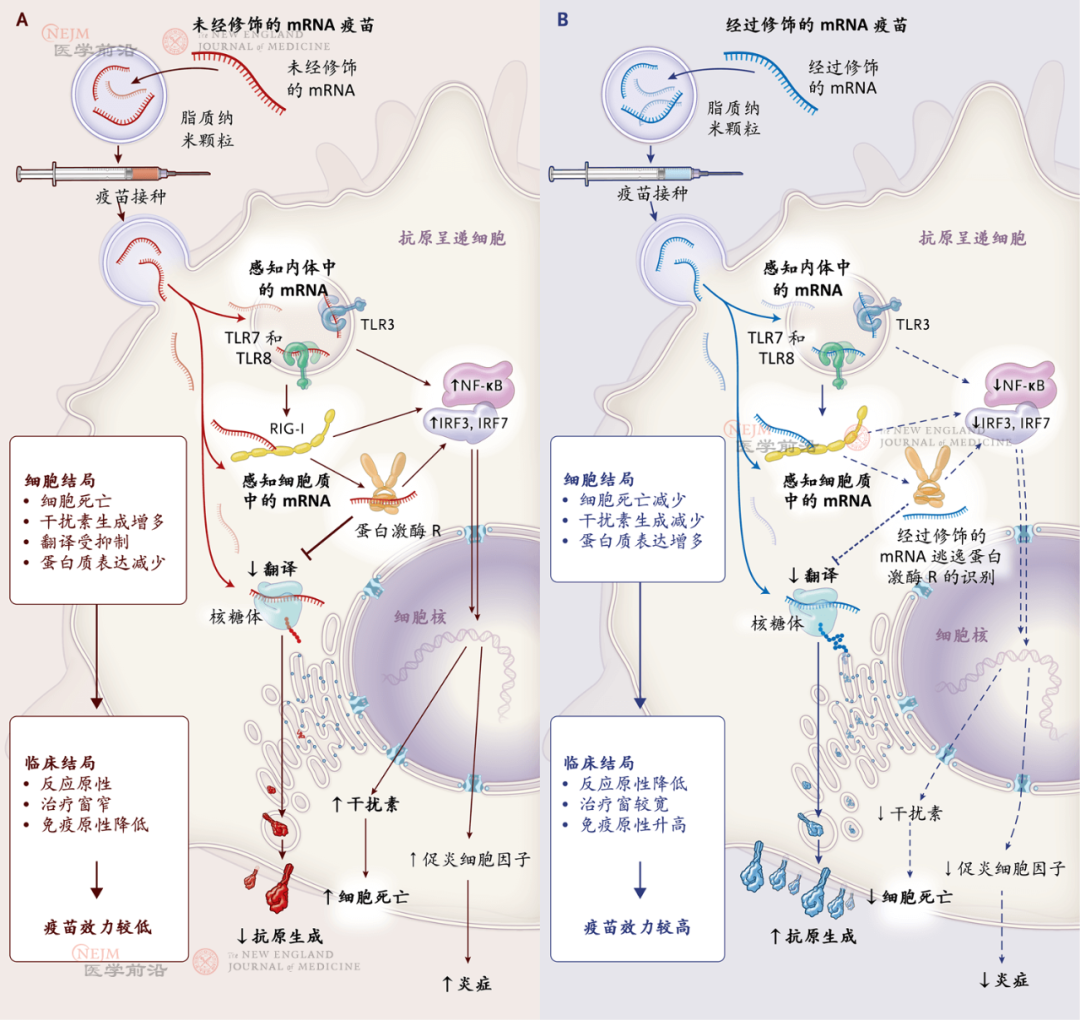
图1. 在疫苗中应用未经修饰mRNA和经过修饰mRNA时细胞识别和临床结局
如图A所示,引入细胞内的未经修饰mRNA与内体和胞质模式识别受体结合,诱导细胞死亡或炎症反应。此外,蛋白激酶R识别未经修饰mRNA后会关闭蛋白质合成并降低抗原表达水平。含未经修饰mRNA的疫苗反应原性较高,治疗窗窄,免疫原性较低。如图B所示,通过添加假尿苷方式修饰mRNA不与细胞内和胞质模式识别受体结合,表现为炎症和细胞死亡均减少。经过修饰的mRNA不会激活蛋白激酶R,因此蛋白质持续表达,免疫原性强。在临床应用中,与含有未经修饰mRNA疫苗相比,含有经过修饰mRNA疫苗反应原性低,治疗窗宽,免疫原性高。IRF表示干扰素调节因子,NF表示核因子,RIG-I表示维甲酸诱导基因I蛋白,TLR 表示toll样受体。
最后的突破是确定使mRNA免于发生水解的最佳包装方式,以及使其进入细胞质的最佳递送方式。多种mRNA制剂已在针对其他病毒的多种疫苗中进行过试验。2017年,来自此类试验的临床证据证明,采用脂质纳米颗粒包裹和递送mRNA疫苗可增强免疫原性,同时维持可控的安全性。
在动物中开展的支持性研究表明,脂质纳米颗粒靶向引流淋巴结中抗原呈递细胞,并通过诱导特定类型滤泡CD4辅助性T细胞激活的方式辅助应答。此类T细胞可增加抗体生成量、长寿浆细胞数量和成熟B细胞应答程度。目前获得许可的两种COVID-19 mRNA疫苗均采用脂质纳米颗粒制剂。
非常幸运,基础研究领域的这些进展在疫情大流行之前完成,因而制药公司可以蓄势待发,一举成功。mRNA疫苗安全、有效且可量产;目前已接种超过10亿剂mRNA疫苗,而2021年和2022年可否将疫苗产量进一步扩大至20亿~40亿剂对于全球抗击COVID-19疫情至关重要。遗憾的是,这些救命手段可及性存在严重不平等,目前mRNA疫苗大多在高收入国家接种;而在疫苗达到最大产量之前,不平等将持续存在。
更广义地说,mRNA预示着疫苗学领域的新曙光,为我们提供了预防其他传染病的机会,例如改进流感疫苗,以及为疟疾、HIV和结核等导致大量患者死亡且常规方法相对无效的疾病研发疫苗。癌症等疾病因为疫苗研发成功概率低且需要个体化疫苗,以前认为难以对付,现在我们也可以考虑为其研发疫苗。mRNA意义不仅在于疫苗。我们迄今为患者注射的mRNA已达到数十亿剂,证明了其安全性,这为其他RNA疗法铺平了道路,例如蛋白质替代、RNA干扰和CRISPR-Cas(规律成簇的间隔短回文重复序列和相关Cas核酸内切酶)基因编辑。RNA革命刚刚开启。
Weissman和Karikó的科学成就已挽救数百万人生命,而Karikó职业历程也令人动容,这不是因为其独特,而是因为其普遍。她来自一个东欧国家,出身于平民,后来移民到美国追求科学梦想,结果却挣扎于美国的终身教职制度、多年岌岌可危的科研经费,直至降职。她甚至为维持实验室运转和继续开展研究而同意减薪。Karikó的科学之旅十分艰难,而在学术界工作的许多女性、移民和少数族群都对此并不陌生。如果你曾有幸见过Karikó博士,你会发现她体现了谦逊二字的本意;可能正是过去经历的艰辛让她脚踏实地。
Weissman和Karikó的艰辛工作和伟大成就体现了科学进程的方方面面。不积跬步,无以至千里。他们的工作漫长而艰辛,需要坚韧、智慧和远见。我们当然不能忘记世界上仍有许多人没有机会接种疫苗,与此同时我们这些有幸接种COVID-19疫苗的人也感激疫苗的保护作用。祝贺两位基础科学家,正是他们的杰出工作使mRNA疫苗成真。我要和许多人一起,向他们表达无尽的感激之情。



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


