
点击蓝字 关注我们

微末生物
Nanomega BioAI
冷冻电镜技术是一种利用低温条件和电子束来观察生物或其他敏感样品的结构的方法。它可以获得高分辨率的图像,甚至达到原子级别。冷冻电镜技术在生物学、医学、材料科学等领域有着广泛的应用,是一种非常先进和重要的科学技术。
冷冻电镜技术的发展经历了几个革命性的突破,主要包括以下几点:
1. 样品的快速冷冻技术,使得水分子被固定在玻璃化的状态,避免了冰晶的形成和样品的变形。
2. 低剂量的图像采集方案,降低了电子对样品的损伤,提高了图像的信噪比。
3. 直接电子检测相机的研发,提高了图像的灵敏度和对比度,使得冷冻电镜的分辨率得到了飞跃式的提升,被称为“第一次分辨率革命”。
4. 图像处理算法的应用,如单颗粒分析法和电子断层扫描法,使得从二维图像重构三维结构成为可能,提高了结构的精度和完整性。
5. 电镜本身的技术发展,如加速电压的提高,使得冷冻电镜能够观察到原子分辨率的信息,如水分子的氢氧原子,被称为“第二次分辨率革命”。
然而,在冷冻电镜“分辨率革命”之前,冷冻电镜的分辨率远不及传统的晶体衍射技术,很难实现原子级的结构解析。在这样的背景下,仍旧有许多科研团队深耕冷冻电镜领域,想要发掘其潜力。来自加州大学洛杉矶分校的周正洪教授团队正是如此,他的团队在2008年首次在3.88Å超高分辨率条件下获得了细胞质多角体病毒(Cytoplasmic Polyhedrosis Virus,CPV)的完整三维结构,实现了病毒个体原子级解析,这是在冷冻电镜分辨率革命前的一项重大突破,也让科研工作者们看到了冷冻电镜的潜力。
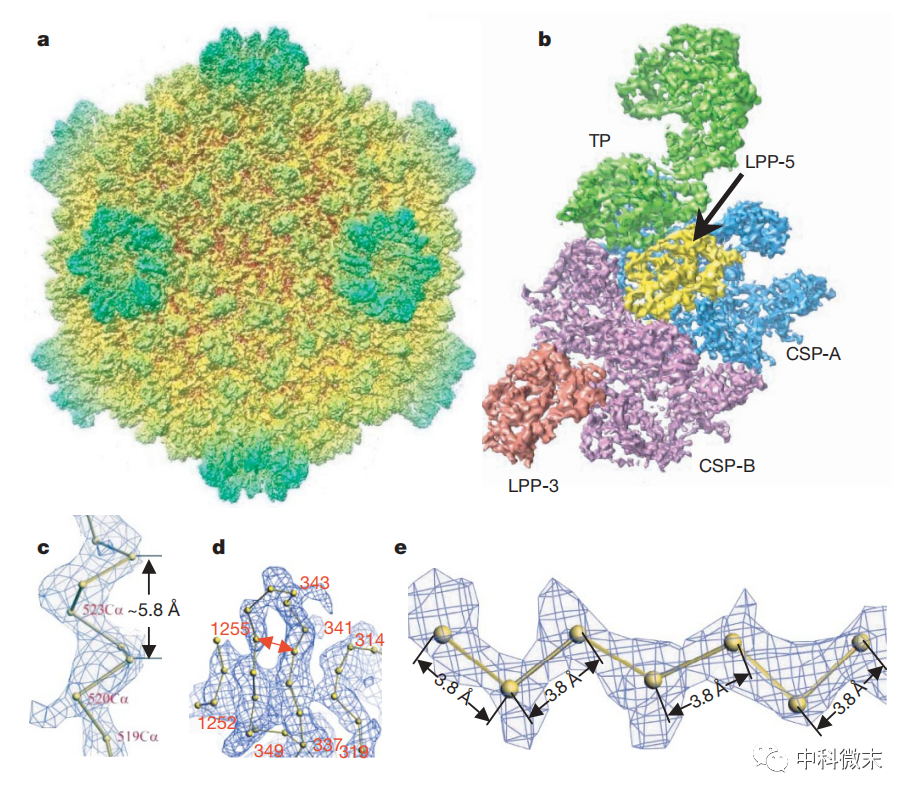
图1 冷冻电镜揭示CPV病毒整体结构
CPV是一类广泛传染昆虫的RNA病毒,可感染家蚕等经济类昆虫,感染严重时可对丝绸产业造成每年数十亿元的经济损失。为了揭示病毒的微观结构与感染机制,周老师的团队利用冷冻电镜单颗粒技术,在3.88Å超高分辨率条件下获得了CPV的完整三维结构,实现了病毒个体原子级解析。该结构清晰展示病毒的关键组分:壳蛋白与viral RNA的交互作用,存在α螺旋向β发卡结构转变,这可能与病毒的RNA的打包、复制和转录过程相关;存在一处与mRNA加帽和释放机制相关的独特口袋结构域;确定了多面体蛋白结合区域,为设计聚合物化抑制剂提供靶点。这些发现为理解病毒自我复制机制、设计相关抑制剂奠定了基础。
病毒RNA运输与定位的构象依赖机制
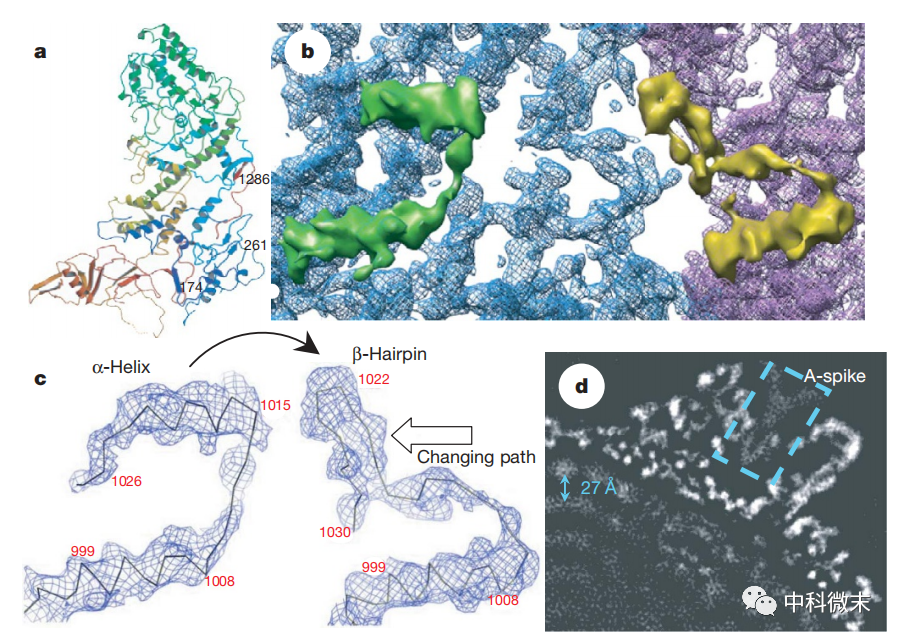
图2 电子密度图揭示壳蛋白两种构象的转变
病毒RNA的正确定位与运送对其复制和释放过程至关重要。研究显示,CPV的壳蛋白与RNA高度亲和相互作用的区域存在明显的构象变化,其中一个α螺旋结构能在不同构象下转变为β发卡结构。这种构象转变可能会改变RNA与之结合的模式,从而影响RNA在病毒内部的精确定位。
具体而言,当壳蛋白处于构象1时,α螺旋与RNA紧密结合,可能将RNA固定在靠近病毒外壳的位置。这可能有利于RNA与病毒RNA聚合酶的相互作用,开启RNA的复制过程。当壳蛋白转为构象2,β发卡区域结合RNA,这可能将RNA向病毒内核更深处转运,有助于完成RNA的折叠、修饰和加帽。
因此,研究者猜测壳蛋白的这种构象转换机制是病毒实现RNA在体内精确定位与运輸的重要途径之一。这种定位和运输对RNA的复制、加工以及最后释放到宿主细胞都是必不可少的。
mRNA加帽与释放的耦合机制
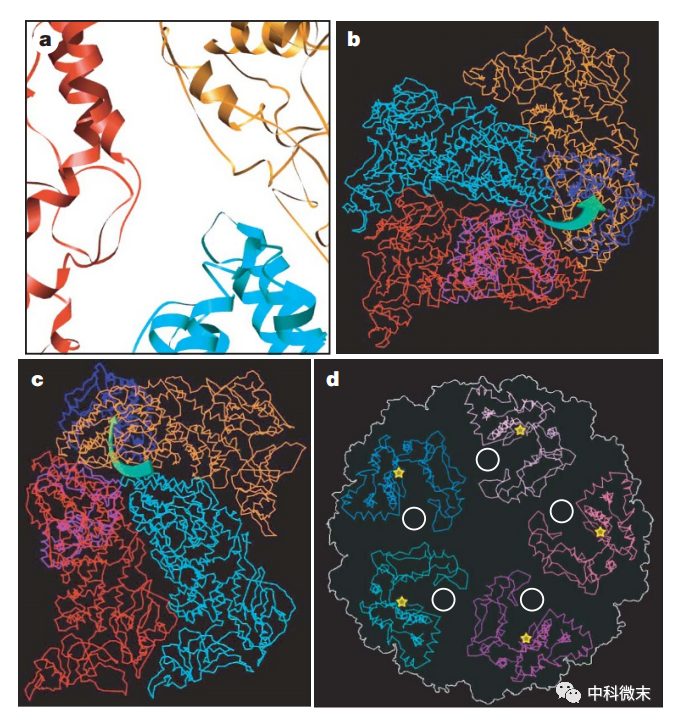
图3 CPV特有的RNA释放通道
mRNA从病毒体内释放前必须经过加帽修饰,这对保证其在胞浆内的稳定性非常关键。研究发现CPV的mRNA释放通道正对着一个独特的RNA加帽结构域,这使新生成的RNA可以高效地到达加帽部位。这种结构上的精妙设计是其他病毒所没有的。
具体而言,很多病毒的mRNA都是经过五聚体轴孔释放的,而CPV外壳附近区域形成的每一个RNA释放孔都不在五聚体轴孔旁,而是靠近旁边的三聚体。更神奇的是,就在这些释放孔周围区域坐落着一个类似“帽子工厂”的加帽结构域,专门用于修饰和加工新释放的RNA。这意味着当RNA离开病毒外壳时,几乎“无路可走”,必须第一时间与这个加帽结构域相遇。这样就可以最大化确保新产生的每一条mRNA链都被修饰加帽后再释放到细胞质中,从而不会由于裸露而快速降解。
这种精妙的结构设计充分体现了病毒高效的存活策略。它也为人类设计相关的RNA释放或加帽抑制剂提供了绝佳的机会,这可能会成为防治CPV感染的有效途径。
多面体蛋白特异性包裹与应用
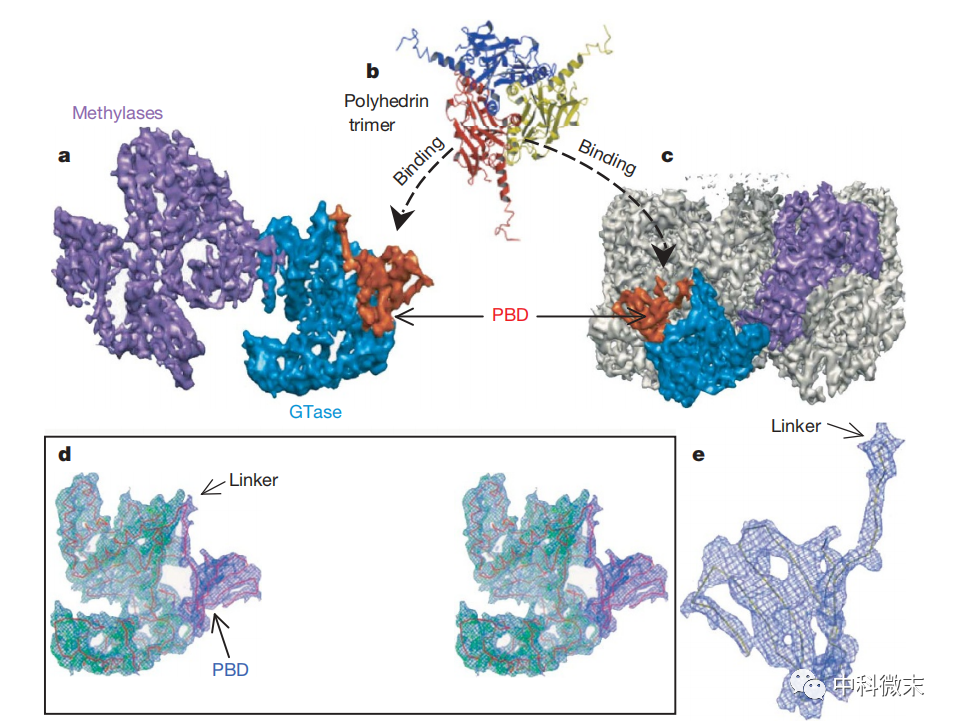
图4 CPV外壳中存在的多面体蛋白结合区域
研究还发现CPV外壳上存在一个多面体蛋白结合区域,这是其他病毒所没有的特殊结构。它赋予CPV可以被宿主细胞产生的多面体蛋白高效且特异性地所包裹的独特能力。在包裹后,大量CPV病毒颗粒会与多面体蛋白形成具有一定晶体结构的复合体“包涵体”。这种包裹不会破坏病毒的感染性,但可将病毒颗粒聚集,降低其扩散速度。这也是病毒得以在宿主体内快速增殖的重要条件。
除自身存在价值外,这一特异性蛋白-蛋白交互作用也为人类创造了利用多面体蛋白作为载体导入各种免疫原抗原的契机。也即是说,通过工程方法在多面体蛋白上连接不同的免疫原,就可以利用它与CPV多面体结合区域的亲和力,将这些抗原高效地送达体内,从而激发机体产生特异性免疫应答。这为设计多种创新和安全的病毒载体疫苗打开了大门。
冷冻电镜挑战与机遇
综上而言,该研究在分子和原子水平上展示了清晰可见的多种结构域,这为理解病毒的组装、RNA的复制和加工、以及多面体蛋白的特异性包裹机制提供了详尽的结构基础。需要说明的是,此前针对病毒个体的结构生物学研究多局限于较低的分辨率,很难实现关键部位的精细解析。该项研究证明了冷冻电镜单颗粒技术可以真正做到原子级还原病原体结构。同时,相较当时结构生物学主流手段,它拥有操作简便、成像速度快等诸多优势,分辨率也更高,为疾病诊断、疫苗设计、药物开发提供了极大便利。
如今,冷冻电镜技术正在迎来多个新的里程碑式突破:获得更多不同类型病毒的原子结构,解析更加庞大和复杂的蛋白机器的“动态结构”等,可谓Science的“明日之星”。同时,人工智能和深度学习的加入也加速了复杂结构的解析;可以预见,经过系统优化与协同创新,冷冻电镜技术必将成为大规模解析超大型蛋白质机器原子结构的必备工具。它也将催生更多基于超微形态的精准诊断技术、新型疫苗和抗病毒药物的应用,给相关领域的发展带来革命性影响。如今,越来越多的科研人员和生物医药企业也意识到,优质的结构生物学研究服务,将大大提高他们研发过程的效率。
中科微末,作为深耕于结构生物学和AI领域的企业,已充分认识到提供优质结构解析服务的重要意义。中科微末依托自主研发的冷冻电镜技术,专注为生物医药企业提供结构生物学研究服务,实现目标蛋白原子级高分辨率的结构解析。团队成员累积发表400+顶级SCI期刊论文,团队手握多项专利软著,在冷冻电镜技术工作流每个环节累积了大量独家算法和专利,可以提供“高难度结构有解决方案,低难度结构更迅速价格更便宜”的技术服务。展望未来,中科微末将继续致力于冷冻电子显微技术的研发和创新,持续推出更多切合客户需求的结构解析解决方案。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


