编译 | 曾全晨
审稿 | 王建民
今天为大家介绍的是来自Yang Zhao团队的一篇论文。snoRNAs是一种在细胞核中常见的小分子RNA,主要帮助修饰细胞内的rRNA。最近,科学家们发现,snoRNAs不仅参与rRNA的修饰,还参与其他RNA,如tRNA和mRNA的修饰。有些snoRNAs与肿瘤的形成和发展有关,它们在肿瘤中的表现也可能与患者的预后相关。这篇综述主要总结了snoRNAs的功能,它们如何影响肿瘤的形成,以及如何将这些知识应用于未来的肿瘤诊断和治疗。

snoRNAs是一类特殊的小型RNA,主要存在于细胞核内。它们的长度介于60-300个核苷酸之间,并主要编码于基因的内含子区域。基于它们的特征,snoRNAs分为三类:H/ACA盒、C/D盒和scaRNAs。H/ACA盒和C/D盒snoRNAs的主要工作是帮助修饰rRNA。它们通过添加特定的化学标记来完成这项工作。而scaRNAs位于细胞的特定区域——Cajal bodies中,它们也有类似的修饰功能。这些snoRNAs与特定的蛋白结合,形成一个工作团队,共同完成对rRNA的修饰。每一种snoRNA都有其特定的蛋白伙伴(图1)。
C/D盒snoRNAs的长度通常在70到120核苷酸之间,它们在其结构中有两个特定的区域,称为C盒和D盒。这两个区域帮助snoRNA折叠成特定的形状,并与其蛋白伙伴结合,完成对rRNA的修饰。H/ACA盒snoRNAs的长度通常在60-75核苷酸之间。它们有一个特殊的区域,可以帮助它们对rRNA进行另一种类型的修饰(图2)。有趣的是,还有一些snoRNAs,被称为“孤儿snoRNAs”,它们不参与rRNA的修饰。尽管它们的主要功能尚不清楚,但研究表明,它们可能与其他细胞过程有关,例如调控基因的活性。
越来越多的研究表明snoRNAs在癌症中起重要作用,例如肺癌、胃癌和乳腺癌。这篇综述旨在深入探讨snoRNAs的功能,它们在细胞过程中的调控机制,以及它们在癌症发病机制中的作用。
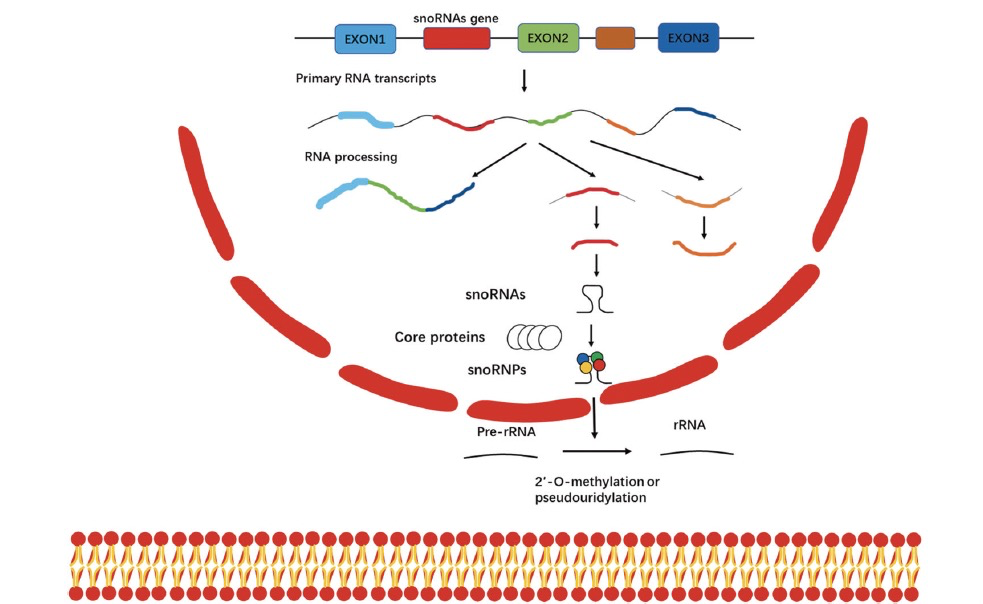
图 1
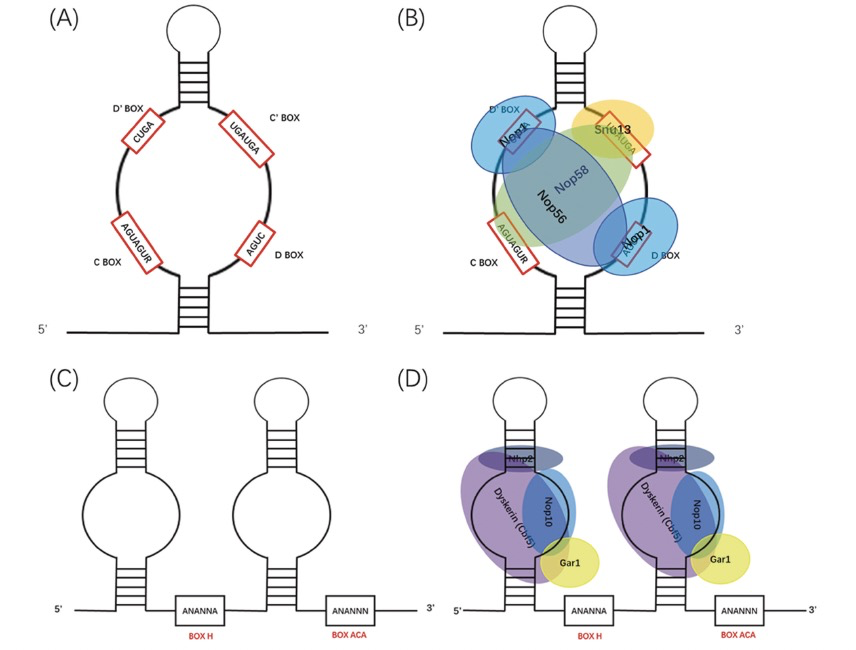
图 2
snoRNAs在生物过程中的作用
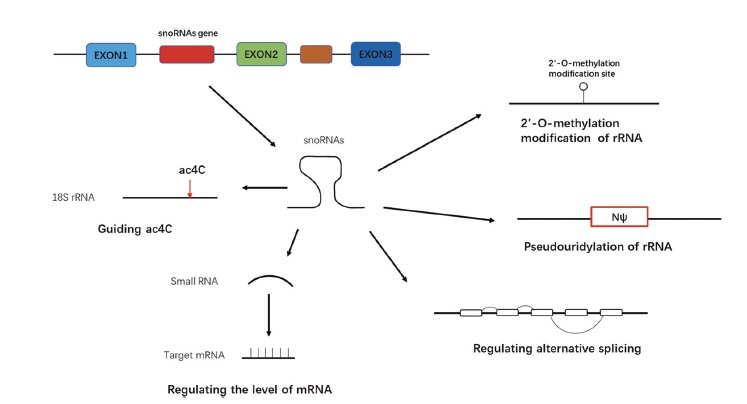
图 3
snoRNAs最常见的功能包括rRNA的2′-O-甲基化和假尿嘧啶化。近年来,对snoRNAs的研究不断增加,多项研究已证实snoRNAs还可以通过引导N4-乙酰胞嘧啶(ac4C)修饰、调控可变剪接(AS)以及执行miRNA类似的功能来调控细胞生理,见图3。
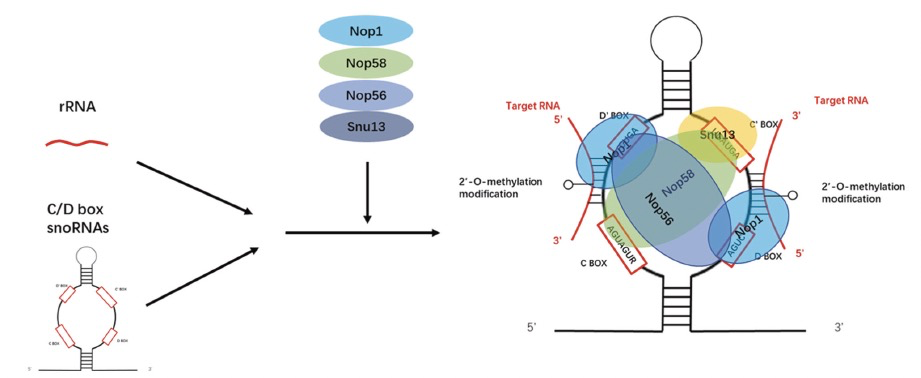
图 4
1981年,Langberg等人首次在HeLa细胞提取物中检测到甲基转移酶活性。2000年,人们发现C/D盒snoRNP复合物的一个成员,即Nop1p,在序列和结构模式上与甲基转移酶相似。虽然所有的C/D盒snoRNAs都包含C盒和D盒,但其中大部分还包含两个额外的组成部分:C′盒和D′盒。一个或两个反义元件位于D盒和/或D′盒的上游。这些反义元件的序列与目标rRNA的序列互补,因此,snoRNAs通过这些反义元件与目标rRNAs结合。作为甲基转移酶,Nop1p是snoRNPs的关键组成部分。它将SAM的甲基转移到目标RNA的核糖分子的2′-羟基上。甲基的引入改变了目标RNA的空间结构,增加了其疏水性,保护了RNA分子免受核酸酶的攻击(图4)。
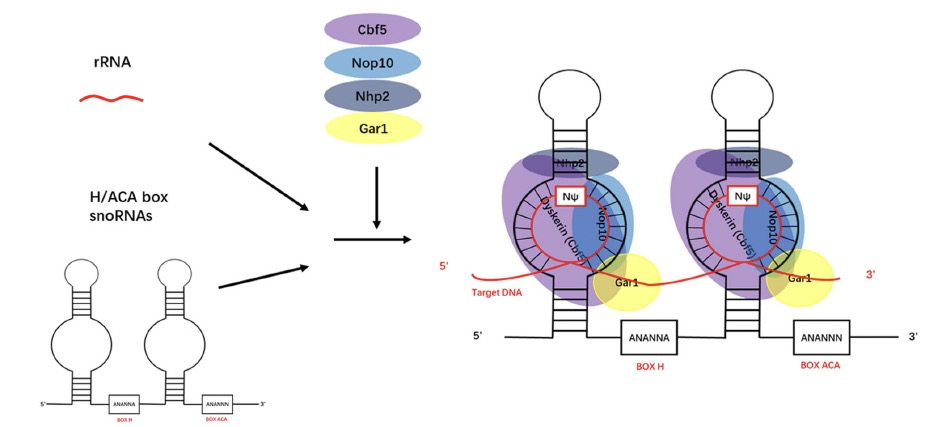
图 5
假尿嘧啶化是最普遍的RNA修饰,并且可以在所有种类的细胞RNA中找到。假尿嘧啶化可以维持RNA的稳定性,并调节核糖体的合成。此外,它在将无义密码子转化为有义密码子中起着重要作用。1951年,Cohn首次发现了一个新的核苷,不久后就被命名为假尿嘧啶。目前,已知有两种假尿嘧啶化方式:RNA独立和RNA依赖。RNA独立的假尿嘧啶化可以通过称为假尿嘧啶合成酶的酶来实现,而RNA依赖的假尿嘧啶化需要H/ACA盒snoRNPs。H/ACA盒snoRNAs绑定到目标RNA,并将目标尿嘧啶转化为假尿嘧啶,从而增加了目标特异性。这种修饰发生在H/ACA盒snoRNAs的假尿嘧啶化口袋中。此外,Cbf5p也可以作为一个独立的假尿嘧啶合成酶并修饰转移RNA(tRNA)底物,图5所示。
作为一种高度保守的RNA修饰,N4-乙酰胞嘧啶(ac4C)可以在rRNAs、tRNAs和mRNAs上找到。1978年,Thomas等人发现鼠、鸡和芽生酵母的核糖体中存在ac4C。随后,发现乙酰转移酶NAT10和Kre33分别在人类和酵母中催化ac4C的修饰。NAT10是一种依赖于ATP的RNA乙酰转移酶,对于有丝分裂和核仁形成是必需的。已经报道说,NAT10还可以调节DNA损伤应答和端粒酶功能。真核18 S rRNAs包含两个乙酰化的胞嘧啶,一个位于螺旋34,另一个位于螺旋45。前者对于翻译的准确性至关重要,而后者是核糖体解码位点的一部分。在snoRNAs的帮助下,NAT10可以催化rRNA上的ac4C的形成。
替代性剪接(AS)是真核细胞中的一个关键的转录后修饰过程,允许一个基因产生多种蛋白质异构体,从而扩大了蛋白质组的复杂性。AS的动态受到多种因素的调节,从pre-mRNA内的顺式作用元件到转式作用的调节蛋白。在真核生物中,AS显著地丰富了编码基因组的蛋白质和转录产物的输出。此外,AS对于基因表达非常重要。通过AS,在哺乳动物中从同一个基因产生的多种mRNA亚型由于它们不同的编码能力、稳定性和翻译效率,被翻译成具有不同结构和功能的蛋白质。一个初级的RNA转录物包含外显子、内含子和插入序列。通过移除内含子和连接拼接的外显子,pre-mRNAs转化为成熟的mRNAs。这个内含子剔除过程是由剪接体催化的。Falaleeva等人证明SNORD27存在于缺乏FBL的核组分中。搜索与SNORD27序列互补的潜在靶标,发现E2F7基因的替代性剪接外显子和SNORD27之间存在互补性。这些发现表明snoRNAs可能参与AS的调节。
snoRNAs在癌症中的作用
关于肺癌中的snoRNAs: 非小细胞肺癌 (NSCLC) 是癌症相关死亡的主要原因。NSCLC 占所有肺癌病例的75%以上,且患者常在晚期被诊断,这大大降低了完全康复的可能性。尽管肺癌治疗取得了显著进展,但NSCLC的预后仍然不容乐观。研究人员已经发现,NOP10(一种H/ACA snoRNA)的水平在NSCLC中上升,并与不良的治疗结果有关。此外,他们还发现,SNORA7A、SNORA7B和SNORA65的敲除以及NOP10的抑制可以减少肺癌细胞的增殖、侵袭和迁移。这些研究结果表明snoRNAs参与了NSCLC的发展。
关于胃癌中的snoRNAs: 胃癌是最常见的恶性肿瘤之一,在全球癌症相关死亡中排名第二。与大多数肿瘤相似,胃癌的治疗包括手术、放疗、化疗和靶向治疗。显然,早期诊断被认为可以显著改善胃癌的治疗效果和预后。研究表明,在胃癌中,SNORD105B通过与ALDOA结合从而上调C-myc的表达,可以促进肿瘤的发生。此外已证实SNORA21的过表达与胃癌的淋巴结转移和远端转移有关。这些研究表明snoRNAs在胃癌的发生和发展中可能发挥重要作用。
关于乳腺癌中的snoRNAs:乳腺癌是女性中最常见的恶性肿瘤,并且是女性癌症相关死亡的主要原因。因此,寻找有效的预后生物标志物和治疗靶点成为了迫切的需求。研究人员已发现乳腺癌中的FBL水平升高。FBL是C/D box snoRNPs的核心蛋白,对snoRNAs的积累很重要,并且可以影响Myc的水平。反过来,Myc也诱导了FBL的表达。同时,FBL的低水平增加了p53的活性,而其过表达则减少了p53的响应。因此,这些发现表明snoRNAs通过调节p53的响应可能促进了乳腺癌的发展。另一项研究发现snoRNA U50介导了28S rRNA中C2848的甲基化,表明它可能作为肿瘤抑制基因样的基因。这些研究表明snoRNAs在乳腺癌的发生和发展中可能发挥重要作用。
snoRNAs与肝细胞癌:肝细胞癌是一种常见的癌症,其致死率很高。由于缺乏早期筛查标志物,大多数肝细胞癌患者在晚期才会被诊断,导致高死亡率。研究人员发现孤儿snoRNA SNORD126促进肝癌细胞增长,并且通过与hnRNPK蛋白结合上调FGFR2,从而激活PI3K-AKT途径。同时,FGFR2的下调抑制了SNORD126高水平的Huh-7细胞的生长。因此,SNORD126似乎通过PI3K-AKT途径调控肝细胞癌的发展。
snoRNAs与卵巢癌 (OC):在所有妇科肿瘤中,卵巢癌的致死率最高。尽管手术和化疗技术不断进步,但被诊断为卵巢癌的女性的五年生存率仍低于30%。研究人员发现SNORA72通过Notch1/c-Myc途径影响卵巢癌中的细胞干性。此外,SNORD89可以通过调节Notch1/c-Myc途径影响OC中的细胞增殖、侵袭、迁移和自我更新能力。
snoRNAs与白血病:白血病分为几种类型,包括急性淋巴细胞性白血病、急性髓性白血病 (AML)、慢性淋巴细胞性白血病和慢性髓性白血病。白血病的主要治疗策略包括化疗和放疗,尽管前者导致严重的毒性和不良反应。研究人员发现在急性早幼粒细胞性白血病中,SNORD112、SNORD113和SNORD114在DLK1-DIO3位点处表达不正常。他们的研究表明,SNORD114-1的变异导致细胞周期在G0/G1阶段停滞并抑制细胞生长。另一项研究证明,SNORD42A的敲除会减少U116的2′-O-甲基化水平,导致核糖体活性和蛋白质翻译减少。SNORD42A缺乏可能抑制恶性细胞的细胞增殖和集落形成能力。总的来说,snoRNAs可能与白血病的发展有关。
参考资料
Huang, Zh., Du, Yp., Wen, Jt. et al. snoRNAs: functions and mechanisms in biological processes, and roles in tumor pathophysiology. Cell Death Discov. 8, 259 (2022).
https://doi.org/10.1038/s41420-022-01056-8



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


