编译 | 曾全晨
审稿 | 王建民
今天为大家介绍的是来自Nehad M. Alajez团队的一篇综述。了解非编码RNA(ncRNA)在我们的DNA中扮演的重要角色对于理解癌症的许多方面至关重要。这些ncRNA是一大类分子,它们不参与制造蛋白质,但在控制我们细胞的各种过程中有着重要的作用。这些过程就像规定我们细胞如何运作的规则。这些ncRNA的工作方式之一是与另一种分子,称为RNA结合蛋白(RBP),进行互动,这种互动在不同类型的癌症中都有详细的了解。它们一起可以影响ncRNA和RBP的稳定性,RNA分子的修改方式,它们在细胞中的位置,以及在癌症中发挥作用的许多其他机制。

在过去几十年里,我们对人类基因组的了解经历了巨大的变革,推翻了关于RNA用途和功能的以往误解。早期,人们普遍认为基因组主要与从DNA到蛋白质的遗传信息传递有关,而大部分转录的RNA被视为“基因组噪音”;这些理论早已被否定。最近,科学界越来越意识到非编码RNA(ncRNA)在几乎所有生物过程中发挥的至关重要作用。ncRNA是一个多功能的群体,根据其产物大小和功能进行分类。这包括长链非编码RNA(lncRNA)、环状RNA、微小RNA(miRNA)、piwiRNA等等。由于其长度超过200个核苷酸且缺乏蛋白质编码潜能,lncRNA一直是研究人员特别关注的对象,因为出现了它们作为多维度调控元素的证据。已经证明lncRNA能够调控基因转录、表观遗传修饰以及其他转录后调控机制。lncRNA主要由RNA聚合酶II转录,并且可以源于基因组的不同部分,包括基因间区域、编码基因的内含子,甚至是增强子区域。它们可以以顺式和反式方式影响基因组的其他部分。顺式作用的lncRNA影响同一染色体上位于相同染色体上的基因的表达,而反式作用的lncRNA影响其他染色体上的基因。与其他类型的RNA(如mRNA)相比,lncRNA的进化保守性较低,其表达被认为有组织特异性。根据GENCODE发布,人类基因组包含18,811个lncRNA基因。在Lnc2Cancer v3.0数据库中,发现了与216个癌症亚型相关的2659个lncRNA。lncRNA可以用作疾病标志物,并可以发挥致癌或抑制肿瘤功能,影响不同的生物过程,如细胞增殖、细胞死亡和耐药性。考虑到它们多功能的特性和广泛的影响,了解lncRNA本身是如何调控的至关重要。
RNA结合蛋白(RBPs)是一组蛋白质,通过结构基序和结构域与不同类别的RNA结合,包括长链非编码RNA(lncRNAs)。这种相互作用会影响lncRNA的加工、修饰、稳定性和功能。在RNA-蛋白质相互作用检测方法方面取得的进展,如交联免疫沉淀(CLIP)和RNA免疫沉淀(RIP),已经使我们能够揭示这些关联。关于癌症中的lncRNA-蛋白质相互作用(LPIs),目前研究已经确定了许多种RBPs与lncRNAs的相互作用,这些相互作用在多种人类癌症中的失调可能导致肿瘤的发展。RBPs通过多种机制发挥其调控作用。例如,人类抗原R(HuR)和丝氨酸/精氨酸富含剪接因子1(SRSF1)与不同的lncRNAs相互作用,通过阻止降解信号并保护它们免受降解,稳定了它们,而另一方面,发现其他RBPs促进了lncRNAs的降解。此外,RBPs还可以与不同的lncRNAs结合,促使它们从细胞核输出到细胞质,从而突显了多种机制对肿瘤的发展的贡献。
癌症中lncRNA-RBP复合物的调控
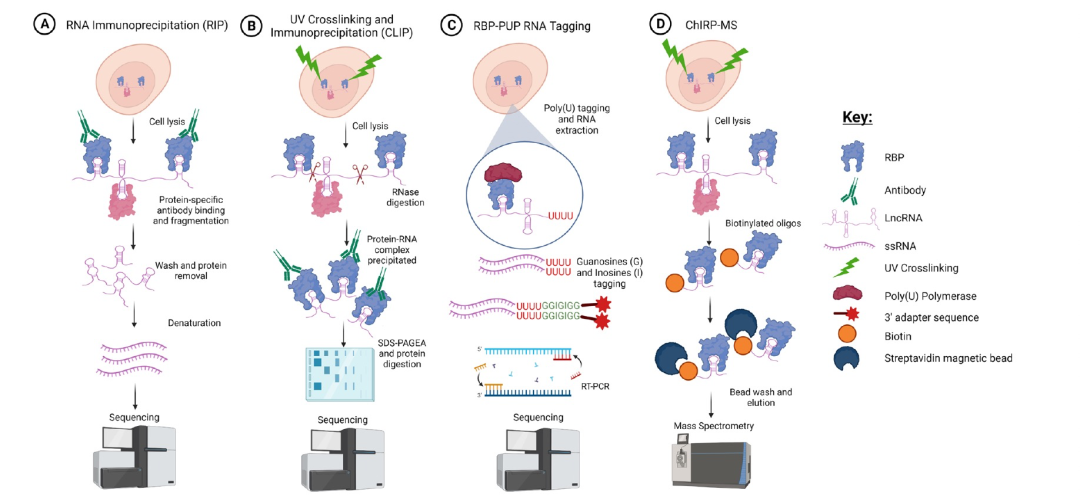
图 1
LPIs(lncRNA-RBP相互作用)可以对lncRNAs和RBPs产生各种调控机制的影响。一些例子包括:a) lncRNA和/或RBP的稳定性,b) m6A修饰,c) RNA选择性剪接,d) lncRNA和/或RBP的亚细胞定位。这些调控机制本质上是复杂且多功能的。在某些情况下,lncRNAs会影响RBPs的稳定性,反之亦然。在其他情况下,RBPs会影响lncRNAs的定位,而在另一些情况下,lncRNAs会影响RBPs在核仁、核质和细胞质之间的定位。我们对这些多样化的相互作用的了解正在增加,但对这些重要关联以及揭示涉及的机制的进一步研究是必要的。
识别LPIs是理解它们在各种生物过程中的作用的第一步。图1A-D显示了用于识别LPIs的不同技术的示意图。用于识别LPIs的大多数实验技术使用RIP(RNA免疫沉淀)法进行,但它也有其局限性。即使净化效率和严格程度非常高,复杂度较低的丰富RNA可能在数据分析过程中逃逸滤波过程,导致假阳性和假阴性的关联。这强调了需要使用机器学习(ML)和深度学习(DL)技术的必要性,以消除在计算上被认为不太可能发生的相互作用,从而简化验证过程。另一种常用于识别LPIs的方法是CLIP。与RIP类似,使用针对感兴趣蛋白质的特定抗体来拉下RBP和目标RNA复合物。但是,CLIP会拉下已经与RNA进行UV交联的蛋白质。现在可以在RNA分离和反转录之后使用下一代测序平台,测序可以识别跨越整个转录组的蛋白质交联位点。还开发了其他几种策略来评估LPIs,包括(RBP-PUP),涉及将感兴趣的RBP与聚尿苷聚合酶(PUP)融合并在3’端尿苷标记RNAs。这些技术通常费时费力,并且需要构建和表达嵌合蛋白质,因此利用基于ML和DL的工具可以帮助节省时间。
LPIs影响长链非编码RNA(lncRNA)和/或RNA结合蛋白(RBP)的稳定性
为了使长链非编码RNA(lncRNA)和RNA结合蛋白(RBP)能够发挥它们的功能,各个组成部分的稳定性对于过程的效率至关重要。一些关于功能半衰期和调控的研究发现,非编码RNA(ncRNA)的功能与它们的稳定性之间存在密切关系。转录本的稳定性取决于许多因素,包括转录本长度、RNA的二级结构、细胞位置以及蛋白质与RNA的相互作用。累积分布分析显示,与mRNA相比,lncRNA的半衰期为3.96小时,这意味着lncRNA的稳定性较低。研究还发现,位于细胞核中的lncRNA比位于细胞质中的lncRNA稳定性较低,并且具有多个外显子的lncRNA比只有一个外显子的lncRNA更稳定。此外,lncRNA是否具有一个或多个外显子还会影响miRNA和蛋白质的结合能力,以及RNA的二级结构自由能。
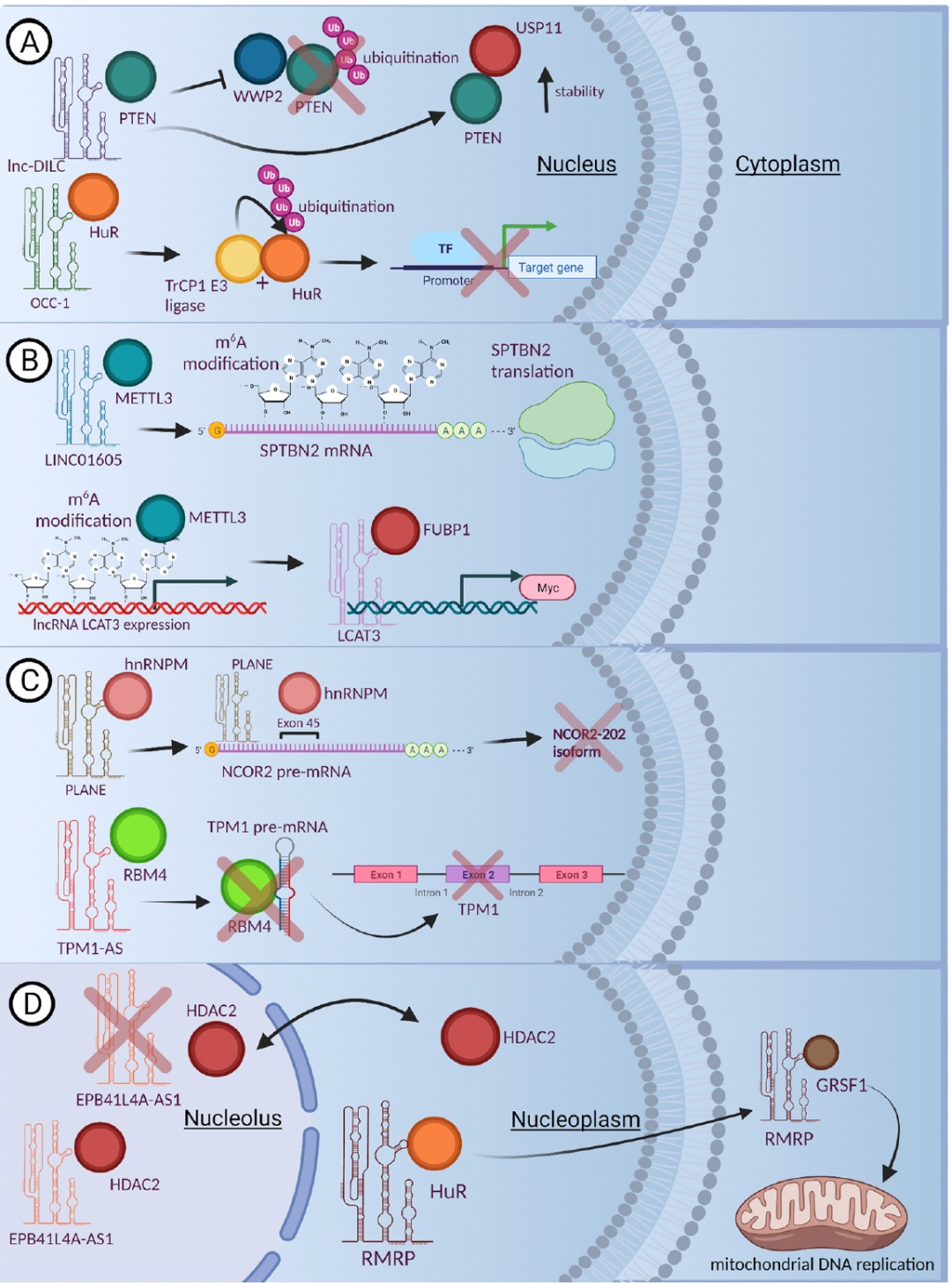
图 2
在肾细胞癌(RCC)中,通过“在肝癌干细胞中下调的lncRNA”(lnc-DILC)的作用,配体-蛋白质相互作用(LPI)有助于磷酸酶和张力蛋白同源物(PTEN)的稳定性。lnc-DILC已被确认在肝癌、膀胱癌和结直肠癌(CRC)等多种癌症中充当抑制肿瘤的作用。研究人员进行的机制研究揭示了lnc-DILC直接与抑制肿瘤的PTEN结合,并抑制其降解(图2A,上方)。因此,恢复lnc-DILC的表达可能为稳定RCC患者中的PTEN提供新的RNA治疗策略。
深入研究LPI在RNA代谢中的作用,不难发现,lncRNA牵涉到真核生物RNA内部的一些最常见、丰富和保守的共转录修饰中。m6A修饰在多个过程中至关重要,如RNA剪接、降解和/或翻译、定位和稳定性。此外,已经在多种癌症类型中描述了lncRNA的m6A修饰,包括喉鳞状细胞癌(LSCC),这表明这些不同的m6A甲基化模式在疾病的发病和进展中起到一定作用。这个复杂的过程包括三种类型的调节因子;甲基转移酶、去甲基化酶,和m6A结合蛋白。有趣的是,研究人员发现LSCC和RCC中的与m6A相关的lncRNA特征可以作为患者复发的潜在预测因子。在肺癌组织中,肺癌相关转录本LCAT3(lncRNA)的表达显著上调,与不良预后相关。这种上调是由m6A修饰介导的,这种修饰增强了LCAT3的稳定性。反过来,LCAT3促进了肺癌细胞的增殖、生存、迁移和转移,无论是在体外还是体内。此外,研究发现,LCAT3分子中的一段特定区域(核苷酸208-342),位于它的一个”弯曲环”区域,能够直接与一种叫做”Far Upstream Element Binding Protein 1″(缩写为FUBP1)的蛋白质相互作用。FUBP1是一个主要的调控因子,参与了基因的转录、剪接和翻译等生物学过程。LCAT3还能将FUBP1引导到MYC基因的序列上(图2b),从而促进MYC基因的转录。
在人类细胞中,一项关键的转录后修饰是能够将来自同一基因的前体mRNA以不同方式剪接成多样的转录本。这种剪接能够满足并引发我们观察到的人类转录组中的巨大变异,同时将我们与其他编码DNA相似但较低级的真核生物区分开来。异质核糖核蛋白M(hnRNPM)是hnRNPs亚家族的一员,参与前体mRNA处理以及mRNA代谢和转运等过程,它包含三个RNA识别结构域(RRMs)。映射实验显示,hnRNPM的核苷酸206-279对其与lncRNA PLANE的结合至关重要。hnRNPM和PLANE都与剪接因子丝氨酸/精氨酸丰富剪接因子共定位,这是核斑的标志物,核斑是剪接前mRNA剪接机器的组装、修改和存储地点(图2C)。
越来越多的证据突显了LPIs在各种细胞过程中作为调控元素的多维作用。其中之一就是LPIs作为靶点或信号,用于定位,这在需要特定元素出现在适当的细胞位置的各种细胞过程中至关重要,无论是在细胞核、细胞质,还是需要在不同细胞区间穿梭的情况。利用The Cancer Genome Atlas和Gene Expression Omnibus的数据集,发现长链非编码RNA红细胞膜蛋白EPB41L4A-AS1在多种癌症类型中下调,并与不良预后相关联。功能丧失实验揭示了这种lncRNA与p53表达呈正相关,并与HDAC2和NPM1都在核仁中共定位。有趣的是,EPB41L4A-AS1的降低导致HDAC2从核仁转位到核质,从而影响组蛋白修饰(图2D)。
长链非编码RNA(lncRNA)和RNA结合蛋白(RBP)复合物的作用机制
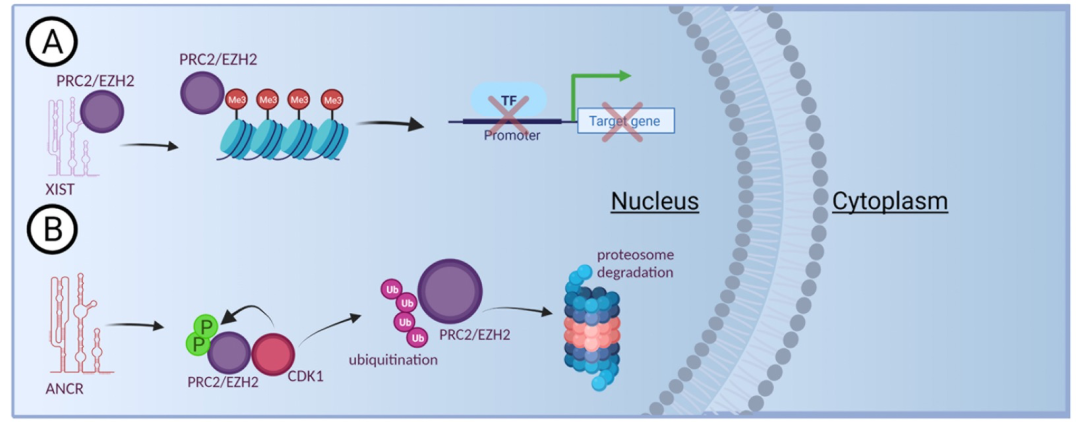
图 3
LPIs在癌症中发挥抑制或致癌作用的机制之一涉及组蛋白修饰和染色质调控。早期的一个例子是通过对X染色体失活(X-inactivation)的研究发现的,这是雌性哺乳动物在早期胚胎发育期间将一个X染色体的复制本紧密包装成异染色质的过程。最早被发现的长链非编码RNA之一,X染色体失活特异性转录本(X-inactive specific transcript,XIST),就是在研究这一现象中被发现的。XIST直接与Polycomb抑制性复合物2(PRC2)的催化亚单位EZH2结合,通过位于其5’端的重复结构域实现结合。PRC2随后对组蛋白H3的赖氨酸27位(H3K27me3)进行甲基化,导致下游靶基因的转录沉默(图3A)。研究表明,除了早期胚胎发育外,XIST还在成年后期发育和癌症中发挥重要作用。XIST的表达下调已在Breast Cancer gene 1(BRCA1)阳性的乳腺癌(BC)和卵巢癌中观察到。XIST还与其他癌症类型有多种关联,如视网膜母细胞瘤、口腔鳞状细胞癌、肝癌和结肠直肠癌等,作为长链非编码RNA-微小RNA-RBP网络的一部分,调控癌症进展。
高表达的EZH2已在多种实体肿瘤文献中有所描述,主要与不利的患者预后相关。因此,研究在转录后水平破坏EZH2并在体内作为潜在肿瘤抑制因子的因子,可以为开发侵袭性癌症的治疗选项提供靶点。研究人员通过实验,鉴定了与EZH2相互作用以调控其稳定性的长链非编码RNA(lncRNAs),作为促使Cyclin-dependent kinase 1(CDK1)与EZH2增加相互作用的催化剂,并随后促进其在Thr345和Thr-487残基上的磷酸化(图3B)。这种修饰使EZH2成为泛素蛋白酶降解的靶点,从而使ANCR成为能够抑制BC细胞迁移和侵袭的活性肿瘤抑制因子。事实上,过表达研究显示,ANCR能够在免疫缺陷小鼠中有效抑制肿瘤发生和转移。
结构与功能域
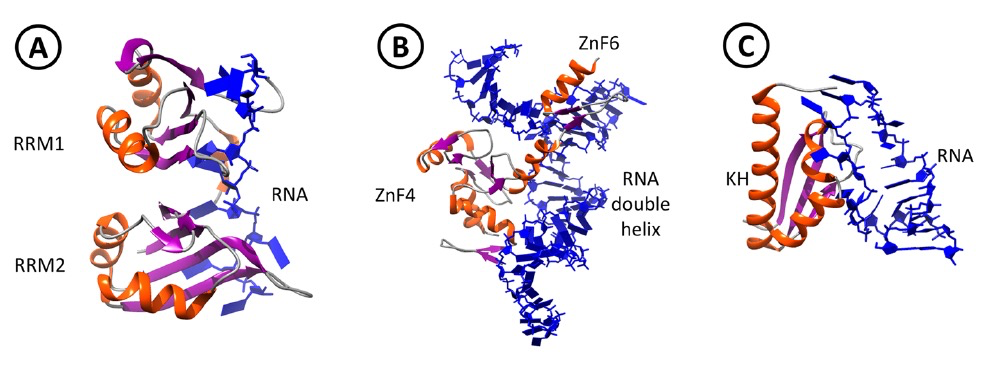
图 4
RBPs(RNA结合蛋白)不仅在RNA代谢、翻译、DNA损伤修复和基因调控中发挥作用,而且在某些情况下也充当RNA分子的“伴侣”,帮助RNA从单链分子折叠成各种二级或三级结构。一旦形成结构,这些特定的RNA序列会充当信号,与其他RBPs形成一个复杂体,介导基因调控。解析RBPs的结构域对于更好地理解它们与长链非编码RNA(lncRNAs)的相互作用以及进行潜在的计算预测至关重要。RBPs由RNA结合域(RBDs)组成,这些域对它们与特定RNA靶标的相互作用至关重要。大多数RBPs包含不止一个RBD,有时还有多个拷贝,显示出一种高度多功能的蛋白质-RNA相互作用方式。单个RBP中存在多个域以及它们的模块化排列有助于协调和增加与RNA的亲和力和特异性。通过X射线晶体学、核磁共振(NMR)以及分子动力学模拟解析的多个结构表明了这些相互作用的动态性质。已经有超过15种经过充分研究的RBDs与RNA相互作用,还有许多域待进一步研究。有三种知名且研究充分的RBDs,分别是RRM、ZnF和KH域。
在高等真核生物中,最常见的RBD是RRM,它们相当小,平均大小为90个氨基酸,仅利用少数残基直接与RNA相互作用。通过氢键、堆叠相互作用以及与RNA核苷酸各部分的额外弱相互作用的组合,实现了特定的结合。这些域采用β1α1β2β3α2β4拓扑结构,有四个β链与两个α螺旋紧密堆叠在一起(图4A),并包含两个保守序列,分别是八个氨基酸的RNP1(RNP八聚体)和六个氨基酸的RNP2(RNP六聚体)。ZnF域非常小,大约有30个氨基酸,采用ββα拓扑结构,可以单独、串联或与其他RBDs组合在一起。这些域包含与ββα折叠的β发夹和α螺旋中的残基协同配位的Zn离子。ZnFs根据其配位层包括CCHH、CCCH或CCCC而进行次分类(C代表半胱氨酸;H代表组氨酸,这两种残基协同配位锌原子)。转录因子IIIA(TFIIIA)包含九个CCHH ZnFs,可以结合DNA或RNA分子。TFIIIA的ZnF4-6与5S rRNA复合物的结构显示,其与RNA双螺旋的骨架相互作用(图4B),并识别单个核苷酸。KH域大约有70个氨基酸长,可以特异性地识别单链RNA(ssRNA)或单链DNA(ssDNA)中的4个核苷酸[115]。存在两种类型的KH域,类型I采用βααββα结构,存在于真核生物中,而类型II采用αββααβ拓扑结构,存在于原核蛋白中。通常,结合处包含一个称为GXXG环的保守基序,位于一侧,另一侧则有一个β-片段,用于容纳核苷酸碱基。组织特异性可变剪接因子Nova2(神经肿瘤性腹膜抗原2)包含3个类型I的KH域。Nova2的KH3域与RNA结合的结构(图4C)表明KH与位于环中的单链5′-UCAC-3’序列相互作用。与RRM和ZnF域相比,KH域缺乏RNA-蛋白质相互叠加的相互作用,这在一定程度上是其低亲和力(微摩尔范围)的原因之一。
结论
在这篇评综述中,作者强调了长链非编码RNA(lncRNA)和RNA结合蛋白(RBP)在癌症发生和不同癌症类型的疾病进展中的至关重要性,它们通过调控各种细胞过程和信号网络来发挥作用。它们的相互作用是广泛且复杂的,这证实了需要继续努力研究这个新兴领域。作者讨论的众多示例为进一步研究影响lncRNA和/或RBP稳定性、亚细胞定位以及lncRNA代谢等机制,以及表观遗传调控等LPI(lncRNA-RBP相互作用)的机制提供了基础。重要的是,LPI在介导癌症治疗抵抗方面发挥了作用。LPI作为潜在的癌症治疗策略的可能性正在等待动物模型和人体临床试验的验证。
参考资料
Shaath, H., Vishnubalaji, R., Elango, R., Kardousha, A., Islam, Z., Qureshi, R., … & Alajez, N. M. (2022, November). Long non-coding RNA and RNA-binding protein interactions in cancer: Experimental and machine learning approaches. In Seminars in Cancer Biology (Vol. 86, pp. 325-345). Academic Press.



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


