
点击蓝字 关注我们

微末生物
Nanomega BioAI
“炭疽”一词相信大家都不陌生,一旦致命的孢子被吸入体内,就会在肺部释放出百万分之一针头大小的炭疽毒素,进而导致人体多器官衰竭,最终死亡。
那么,这种可怕的炭疽毒素究竟是如何在体内施展杀手锏的呢?
来自加州大学洛杉矶分校的周正洪教授团队运用冷冻电镜技术率先取得了炭疽毒素通道高分辨三维结构,通过蛋白结构详细解析了毒素是如何穿过细胞膜并执行致命一击。
该项研究成果发表于《自然》期刊,下面就让我们来一起学习吧。
一、炭疽杀手的毒性来源
炭疽病,又称作疖病,是一种常见的自然疫源性疾病。其病原体为芽胞杆菌属下的炭疽杆菌。这种细菌能在土壤中以芽胞的形式存活数十年之久,主要通过皮肤损伤或者被病畜啃咬等途径感染人畜。一旦入侵人体,芽胞就会在吞噬细胞(如肺泡巨噬细胞)的作用下苏醒并快速增殖,产生三大炭疽毒素作为其破坏人体必杀武器。这三大毒素分别是致死性毒素(Lethal Toxin, LT)、水肿性毒素(Edema Toxin, ET)和保护性抗原(Protective Antigen, PA)。
其中,保护性抗原貌似名称比较友好,但实际上它更像是一个带路人及造桥专家,主要职责是携带另外两大恶名昭彰的真正杀手蛋白穿过细胞防线。只有在保护性抗原的配合下,另两大蛋白才能进入细胞质和核心区施展惊人毒力。当这三大因子齐聚一堂,就会启动机体多脏器衰竭,在短短48小时内夺走患者的生命。
二、保护性抗原孔道的转换与毒性发挥
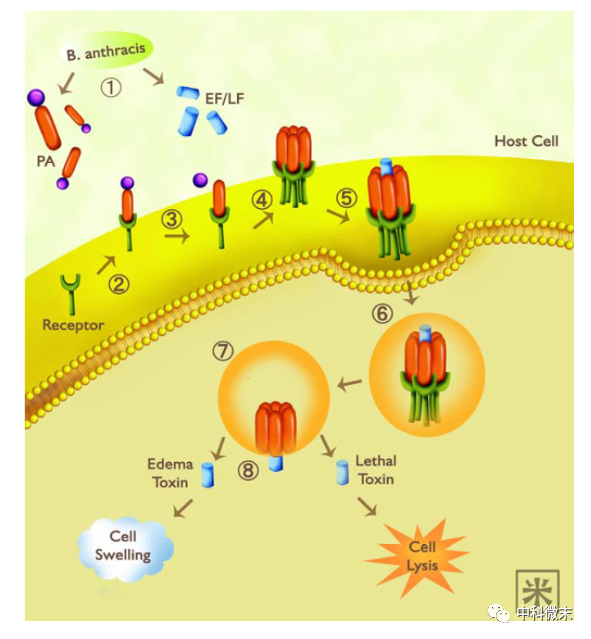
图1 炭疽杆菌毒素侵染巨噬细胞过程:
1. 炭疽杆菌释放三种蛋白质 – 保护性抗原(PA)、水肿因子(EF)和致死因子(LF);
2. 哺乳动物宿主细胞表面受体(炭疽毒素受体,ATR)与非活性PA结合;
3. PA被蛋白酶切割并转换为其活性形式;
4. 活性PA与其他激活的PA结合形成七聚体;
5. EF或LF与PA 七聚体结合;
6. PA-EF/LF复合物通过胞吞作用进入宿主细胞;
7. 内体酸性环境诱导PA 七聚体发生构象变化,然后穿孔内体膜;
8. EF或LF被释放到细胞质中,这些毒素可能破坏正常的细胞功能,甚至导致细胞死亡。
要了解炭疽毒素是如何实施致命攻击的,就必须剖析保护性抗原蛋白的秘密。保护性抗原能自行组装成预结构(Prepore),这种无害的七聚体环状预结构会在被巨噬细胞吞入后,固定在内表面,紧接着在巨噬细胞内吞体酸性条件的刺激下快速转换为穿膜结构(Pore)。这种结构转变极为迅猛,犹如一朵静谧的水仙花瞬间炸开,化为凶猛的食人花。转换后的保护性抗原孔道能深深插进巨噬细胞的细胞膜内部,为其他两大毒素破坏者构建跨膜通道。两大杀手手挽手,借助保护性抗原孔道的搭桥渡槽,一路杀入吞噬细胞内部发动袭击,最终造成巨噬细胞死亡。
保护性抗原在毒素攻防战中的至关重要作用,这也使其成为炭疽病防治和炭疽杆菌感染机制研究的重点。多年来,科学家已经在保护性抗原的预结构层面解析了保护性抗原的奥秘,但对其功能实现的关键——穿膜结构信息却一直是个迷,周老师团队率先解析出保护性抗原的高分辨孔道结构,揭开了该面纱。
三、花朵般绽放的保护性抗原孔道
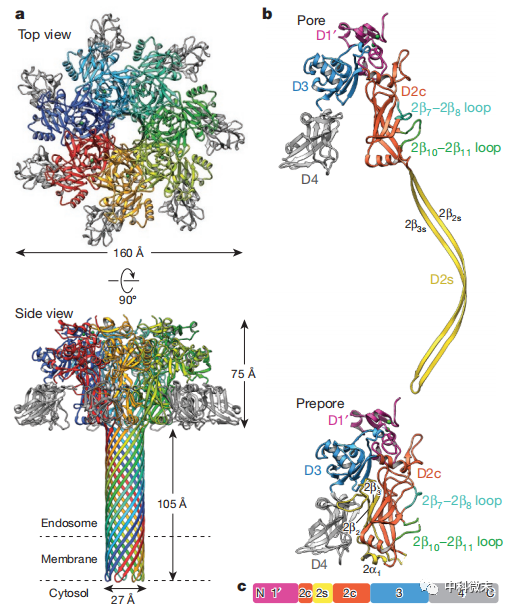
图2 保护性抗原形成的七聚体“花朵”通道以运输毒素
研究团队使用冷冻电镜单颗粒技术,在近原子级分辨率下捕捉到保护性抗原七聚体组装的完整孔道立体结构。其整体呈现花朵状,包括从上到下的花冠、花萼和花托三部分。正是这朵“开到极致”的毒素花,彰显了保护性抗原最大的杀伤力。
在结构中,最上端的花冠区组成复杂,其中保护性抗原单体的1、3和4结构域在边缘呈放射状伸展。继之而下的花萼区则由保护性抗原单体中一截断的2c区域构成,主要负责毒蛋白底物的识别和吸纳。再后续向下是最关键的花托区,这是由保护性抗原单体中高度延展的2s区域折叠组装形成的跨膜桶状结构,它深深刺入脂质双层细胞膜内部,为毒素物质构建通道。
最关键的当属最下部的花托区,这是一段紧密堆叠的直径2.7纳米,长度10.5纳米的无比密实的细长通道。它由保护性抗原单体中高度延展的2s区域折叠组装而成,整整14股顺时针扭转的β螺旋(β barrel)并列排开,紧紧捆扎在一起,共同穿透脂肪双层。如果用一幢大厦来类比,花冠和花萼就像空中花园一般高耸入云,而花托区就是深埋地表以下的地基桩。可以说,这个独特的14股β桶结构就是保护性抗原的根基所在,它为两大杀手毒素搭建了跨膜高速公路,使其得以遂行破坏功能。
四、Φ-夹层构成转运通道瓶颈
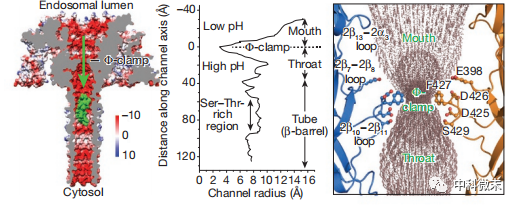
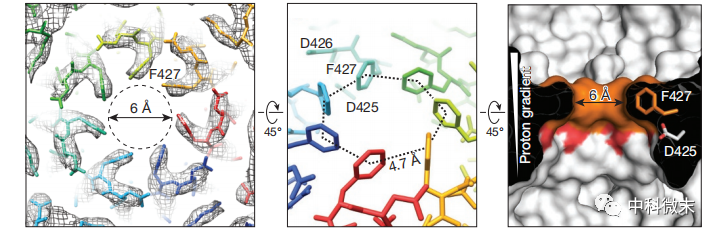
图3 Φ-夹层附近的孔道大小情况以及附近的酸性氨基酸分布
那么,这朵毒素花究竟是如何运转,驱动致命的毒素蛋白通过细胞膜的呢?研究者在保护性抗原的跨膜通道内发现了关键所在——一个高度对称的环形构象,被称为“Φ夹层”。这个由7个苯丙氨酸残基堆叠围合而成的独特结构,犹如一个气密活栓,将整个穿膜通道分隔为两个区域,可谓是通道功能的中枢所在。
Φ夹层上方是通道的口部,空间足够宽敞,可任由二级结构的蛋白质肆意穿行。而下方则是管部,其由14股β桶围出的空间虽较为狭窄,但对于α螺旋结构来说还是绰绰有余。真正的瓶颈在夹层中央,其排除溶剂分子后的通道直径只有约0.6纳米,远小于任何蛋白二级结构的尺寸,因此必须完全展开才能勉强通过。可以看到,整个跨膜通道中只有Φ夹层这个点才会严格限制庞大蛋白分子的通行。这使它成为调控蛋白转运方向性的理想场所。
研究者发现,在Φ夹层两侧分别存在着酸性阴离子环境,这种电荷差异能产生类似“离子跨膜泵”的布朗运动效应,驱动带正电荷的蛋白质单向转运。具体原理是:当底物蛋白质中的酸性氨基酸残基(带负电荷)从细胞内体酸性环境进入通道时,这些负电荷就会被质子化中和;而当它们到达细胞质中性环境后,就会恢复原本的负电荷。这种可逆的充/放电状态转变,配合Φ夹层狭窄空间的操纵,动态地推动带电底物向细胞质一侧单向移动。
简而言之,保护性抗原的Φ夹层与负电异构现象联手,犹如一个精妙绝伦的布朗分子马达,持续输出转运动力,将两大杀手推入细胞内部。
五、炭疽毒素释放机制
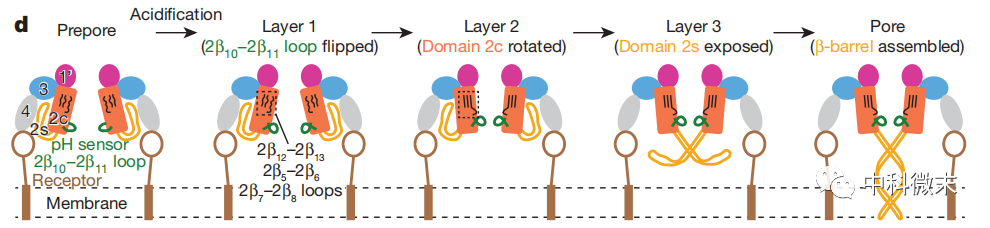
图4 炭疽毒素释放模型
在这项研究中,科学家不仅解析了保护性抗原孔道的立体结构,还根据其与毒素预结构的精确比较,重新梳理了预结构向孔道转化的多步骤激活机制。这为我们理解保护性抗原致命功能的实现提供了切实基础。
结果显示,整个通道的转化分为三个主要层面。首先,在pH传感器2β10-2β11环处,低pH会引起其构象的扭转和开关。这一变化如同扳下的第一道保险栓,将会接力传导给下游结构域发生连锁反应。压力通过相邻2β7-2β8环的下移释放,推动第二层多个环结区域拉直,继而由铰链作用将2c结构域向内15度扭转。若用舞台布景的升降来类比,低pH信号就像导演的嘶吼,驱使酸感环向四周伙伴发出行动号召,伴随着舞台机械的轰鸣,各扇形环板应声而动,瞬间组合出一个密不透风的舞台中央。那里正是Φ夹层的所在地,由七个舞者手挽手围成圆环谢幕,Φ夹层的形成令人震撼,为后续毒素转运埋下伏笔。
在歌剧的高潮部分,四周布景也随之上升。2c区域与4区域的分离为β片层的暴露和折叠铺平道路。于是原本盘绕在毒素中心的14股β前体,在低pH信号破坏其原有地基后,开始解体重组,瞬间架起一座跨膜高塔,为两大杀手点燃通行指示灯。
六、与毒素花异曲同工的细菌穿孔素
有趣的是,这朵耀眼的“毒素花”在总体构造上与大肠杆菌制造的α溶血素(α-haemolysin)和霍乱弧菌溶血素(Vibrio cholerae cytolysin)具有惊人相似性,尽管它们的宿主和致病性有天壤之别。这三大细菌蛋白都能在低pH激活后组装成巨大的跨膜结构,释放致命效应。这类共性说明毒素结构高度保守,进化历程中保留了相似的膜融合机制。
当然它们也存在一定差异。其中,保护性抗原的β桶长度是其他两者的两倍,这可能有助于配体的定位和毒素转运通道的形成。此外,保护性抗原花冠区组成复杂,而其他两种蛋白则相对简单。这种结构差异也许反映了更高等生物体内的细胞结构和免疫系统复杂性。尽管面临更大挑战,但通过与宿主蛋白的共适应性演化,保护性抗原显然获得了不俗的毒性升级与免疫逃逸能力;所以这朵毒素之花绽放后威力更甚,她那迷人的芬芳里暗藏杀机。
这项研究工作推动了科学家们对炭疽毒素感染和防治的理解,也为毒性发挥的动态过程提供了模型依据;同时,对于Φ夹层和pH激活机制的理解也将启发药物设计的灵感,推动针对性疗法的研发。此外,作为一种典型的细菌毒素跨膜转运系统,保护性抗原也可作为试金石,加速科学家们对于生物膜融合,离子转运以及蛋白质转运等基础生物学过程的认知。
冷冻电镜提供的宝贵结构信息,使科学家们得以一窥这类复杂系统的运行机制。中科微末,作为深耕于结构生物学和AI领域的企业,已充分认识到提供优质结构解析服务的重要意义。中科微末依托自主研发的冷冻电镜技术,专注为生物医药企业提供结构生物学研究服务,实现目标蛋白原子级高分辨率的结构解析。团队成员累积发表400+顶级SCI期刊论文,团队手握多项专利软著,在冷冻电镜技术工作流每个环节累积了大量独家算法和专利,可以提供“高难度结构有解决方案,低难度结构更迅速价格更便宜”的技术服务。展望未来,中科微末将继续致力于冷冻电子显微技术的研发和创新,持续推出更多切合客户需求的结构解析解决方案。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


