今天,我想向大家介绍一篇近期发表在国际生物信息学期刊《Briefings in Bioinformatics》上的研究论文:“FormulationAI: a novel web-based platform for drug formulation design driven by artificial intelligence”。论文的通讯作者是澳门大学的欧阳德方老师,第一作者为中南大学董界老师。该论文发布了新一代人工智能药物制剂预测平台,称为FormulationAI,旨在通过人工智能技术改变传统药物制剂设计的局限,系统推动药物制剂设计开发朝着智能化、高效率和经济性的方向发展。平台访问网址:https://formulationai.computpharm.org

FormulationAI平台介绍
药物制剂设计是药物开发过程中的一个关键环节,涉及到药物的物理、化学特性和最终的释放方式。传统的制剂设计依赖于大量的实验和经验判断,这不仅耗时而且成本高昂。随着人工智能技术的兴起,这个领域面临着一次革新的机遇。FormulationAI平台应运而生,它结合了丰富的药物制剂数据和先进的AI算法,旨在优化药物设计流程,提高效率和准确性,减少对实验的依赖。
FormulationAI 在第一阶段重点解决了难溶性药物的增溶问题,药物-环糊精、固体分散体、磷脂复合物、纳米粒晶体、自乳化、脂质体递送等6大体系17种重要性质的智能预测与评估。该平台最显著的特点之一是无需复杂的理论计算或实验室实验就能进行快速预测。这得益于该平台的内置程序,该程序统一了描述符和输入,用户只需提交药物或分子结构,就能快速得到预测结果。图1展示了FormulationAI 的工作流和覆盖的评价指标。
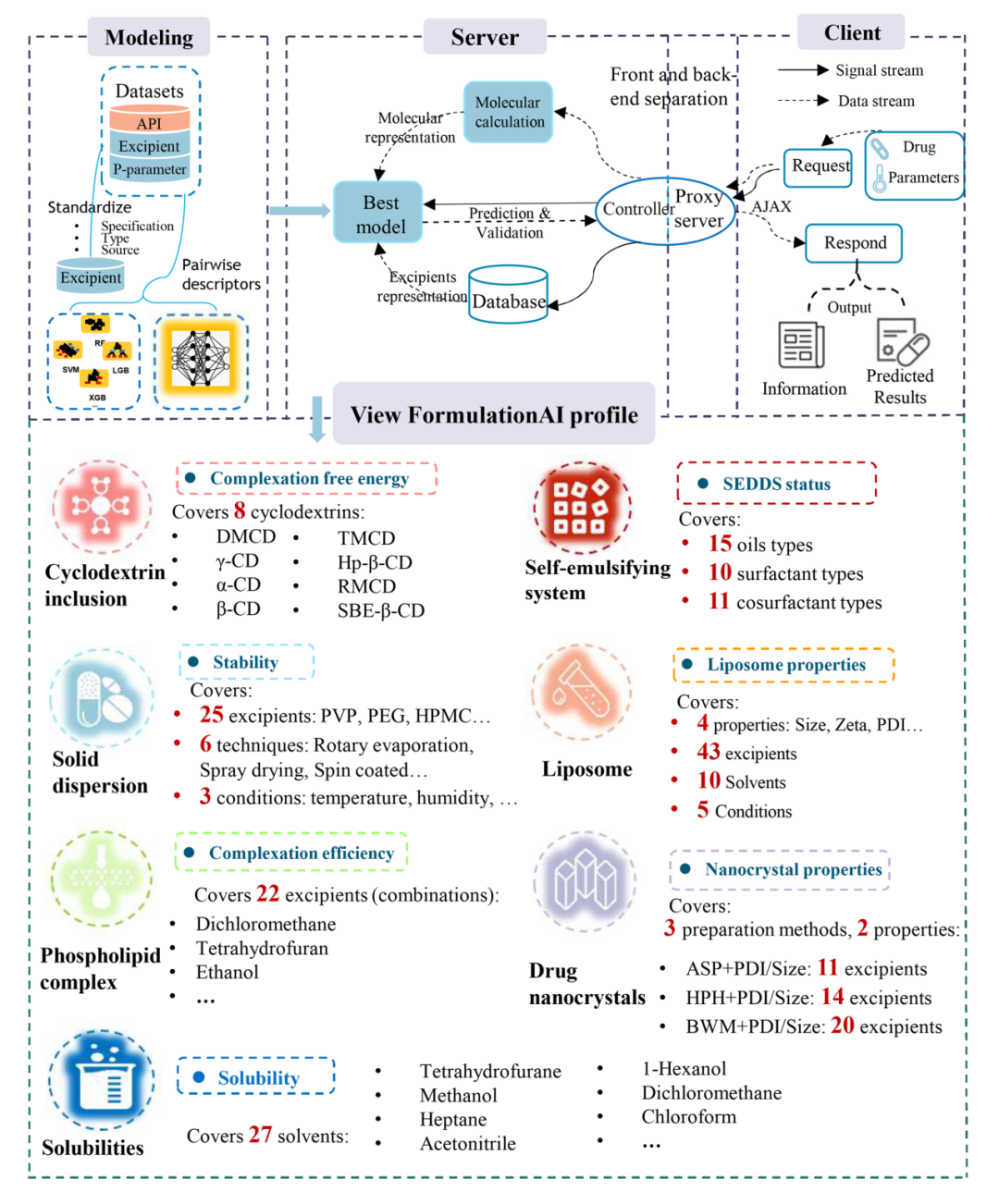
图1. FormulationAI 的工作流程。该平台的实施包括几个阶段。首先,挖掘和清理原始数据。对规格、来源和结构进行了标准化。其次,使用定制的描述符策略对六种递送系统进行了新的表示;利用不同的代表性算法和特征选择方法,为平台部署建立选择准确高效的模型。第三,在模块化计算框架的基础上,建立了一个易于使用的用户界面,以保证最佳效率和智能计算过程。
数据收集与分析
FormulationAI平台的另一个核心特点是其庞大的数据集,包括过去十年中六大主要药物制剂系统的详尽数据(图2)。这些数据覆盖了成分、物理化学性质、稳定性等多个方面。平台使用机器学习和深度学习算法对这些数据进行分析,能够准确预测制剂的多种关键性能,如溶解度、稳定性和粒径等。
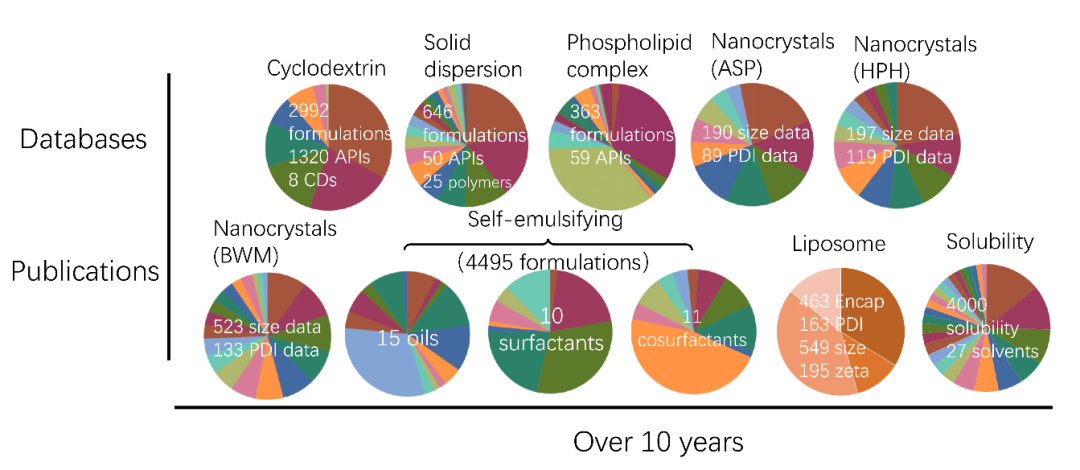
图2. 平台涵盖的数据集概览。
部分结果展示
图 4A 总结了 16 个最佳模型(12 个回归模型和 4 个分类模型)的结果。总体而言,模型的性能令人满意。在回归任务方面,表现最好的模型是药物在不同溶剂中的溶解度预测模型,LightGBM 算法和 RF 算法在该数据集上表现最佳,交叉验证和测试集的 Q2 分别为 0.922 和 0.910。环糊精的络合自由能(ΔG)预测也表现良好,测试集的 R2 为 0.869,交叉验证的 R2 为 0.901。大多数纳米晶体和脂质体预测模型都在可接受的范围内表现良好,但三种纳米晶体制备方法的粒度预测准确性不佳。这部分是由于数据量有限以及添加了稳定剂,使得二元成对描述符变成了三元描述符,稀释了训练空间中的信息。此外,不同辅料的数据比例也会极大地影响模型的准确性。当某些常用辅料的数据量明显高于其他辅料时,模型的准确性就会下降。例如,由于 BWM 数据集中的辅料比例比另外两种方法更均衡,因此两种 BWM 模型的性能优于 ASP 和 HPH 中的相应模型。在分类任务中,所有四个模型都表现良好,测试集 ACC 超过 0.8,AUC 超过 0.9。交叉验证的结果也与测试集的结果一致。
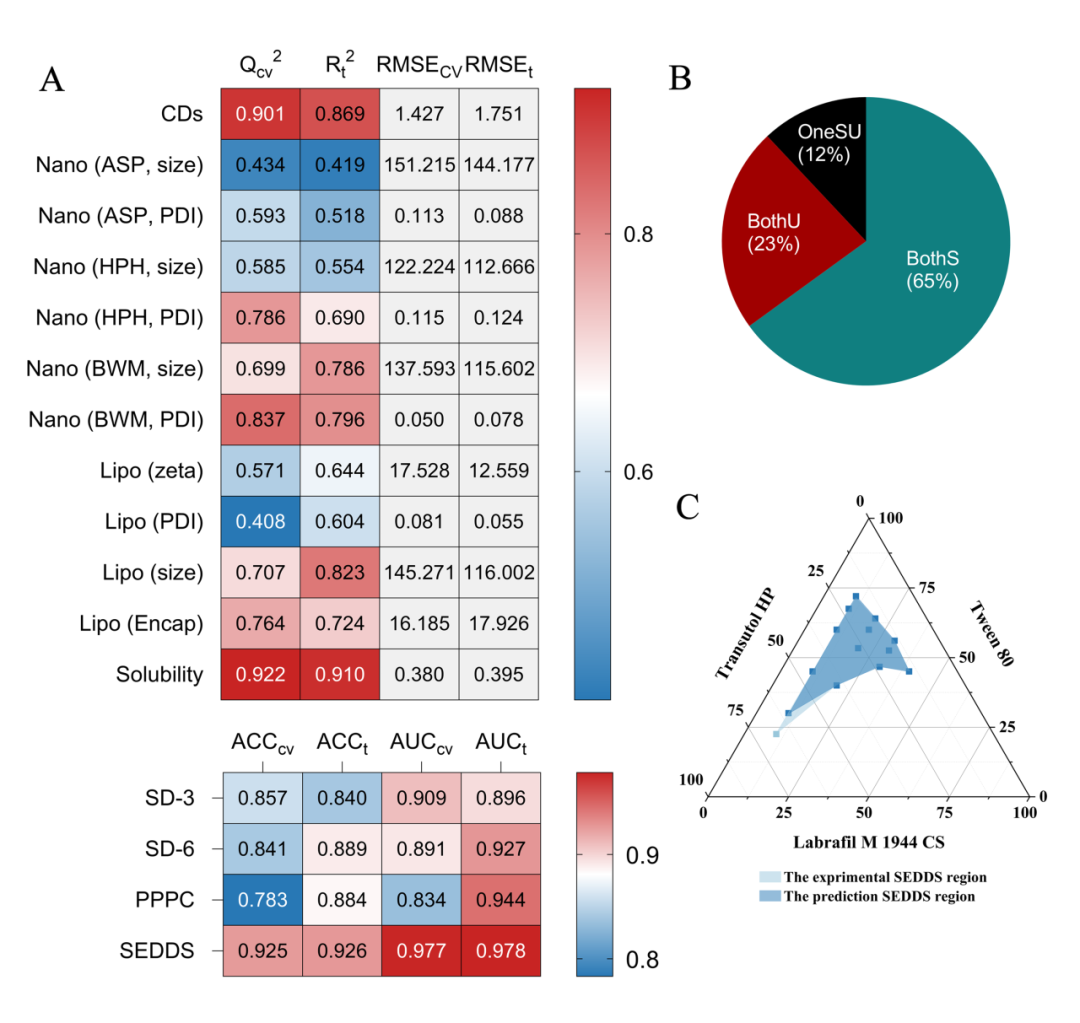
图4. 模型性能统计和所选最佳模型的验证。(A)所有最佳模型的性能,12 个回归模型和 4 个分类模型的最佳结果。可比指标显示为热图,颜色深度代表数值。(B) 预测的 SD 稳定性(3 个月和 6 个月)比例与市售制剂的实验结果对比。”BothS “表示预测 3 个月和 6 个月都稳定的上市制剂。”BothU “表示都不稳定。”OneSU” 表示仅在 6 个月内不稳定。(C)示例 SEDDS 配方的三相图。实验区域和预测区域用不同颜色表示。
使用范例
案例1:在 SD 稳定性预测方面,雌二醇和 PVP K30 是一个特别值得关注的例子。通过填充不同的药物负载比例(1:2、1:5)得出的预测结果,结果显示,1:2 比例的稳定性较差,稳定概率为 0.51(3 个月)和 0.38(6 个月),而 1:5 比例的稳定性相对较好,稳定概率为 0.63(3 个月)和 0.55(6 个月)。这一结果在实际实验中得到了验证,实验结果表明,在 6 个月的加速条件下,1:5 的比例是稳定的,而 1:2 的比例则不稳定[24]。我们还将市售制剂的实验数据与 FormulationAI 的预测结果进行了比较,发现 65% 以上的稳定性结果符合预期(图 4B)。
案例2:另一个例子是使用 Labrafil M 1944 CS、Tween 80 和 Transcutol HP 组合作为油、表面活性剂和助表面活性剂的 SEDDS 配方。首先,输入 20%、64% 和 16%作为油、表面活性剂和助表面活性剂的比例,将表面活性剂和助表面活性剂按 4:1 的质量比混合成混合乳化剂,然后按 2:8 的质量比向混合乳化剂中加入油;将工艺参数设置为 pH = 7.0 和浓度 A = 1%。然后,调整参数,得出表面活性剂和共表面活性剂的六种比例(4:1、3:1、2:1、1:1、1:2 和 1:3)以及油和乳化剂的九种混合比例(1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2 和 9:1)的预测结果。最后,共获得 54 种不同组合,绘制出三相图(图 4C)。结果表明,预测值与实验数据十分吻合。
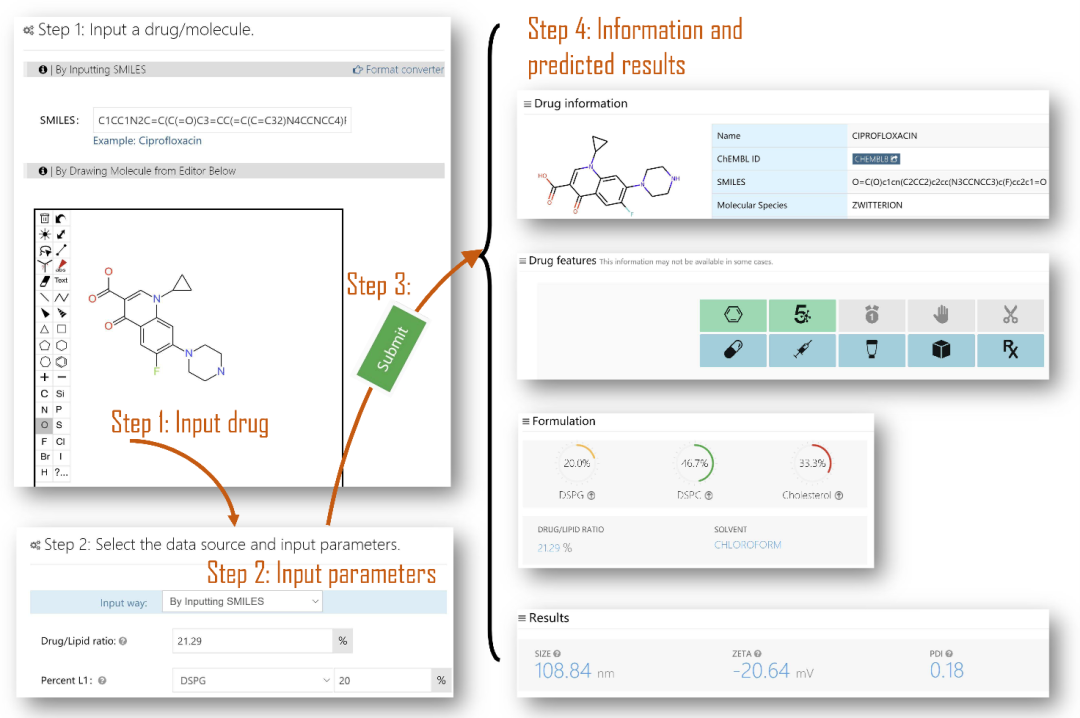
图5. FormulationAI用户界面使用快照。
应用价值
传统依靠实验试错的方法严重限制了药物制剂领域的发展。作者研发的新一代人工智能计算平台可以为药物制剂的体内外行为提供解释和预测,大大加速了药物制剂的评价和筛选。它将传统的制剂开发流程从经验依赖转变为数据驱动的方法论,为药物研发提供了新的工具。在测试阶段,其已收到全世界近200多个著名研究机构和个人试用并给予了正向反馈,研究团队在后期将持续更新和完善平台的功能,期望打造更加全面的计算平台。
FormulationAI 访问地址:
https://formulationai.computpharm.org
参考资料
Dong, J.; Wu, Z.; Xu, H.; Ouyang, D. FormulationAI: A Novel Web-Based Platform for Drug Formulation Design Driven by Artificial Intelligence. Brief. Bioinform. 2023, 25 (1), bbad419.
https://doi.org/10.1093/bib/bbad419



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


