
点击蓝字 关注我们

微末生物
Nanomega BioAI
端粒酶是维系染色体结构稳定的重要组分。上期我们谈到,来自UCLA的周正洪教授团队通过冷冻电镜成像技术首次解析了四膜虫(tetrahymena)染色体保护器端粒酶的三维结构。研究发现端粒酶的催化核心是TERT反转录酶与TER RNA的精妙组装,辅以多个调控蛋白实现端粒DNA的合成。这一突破性成果推进了对端粒酶工作机制的理解,也为设计相关的抗癌和抗衰老药物奠定了基础。
然而,该工作获得的端粒酶样本是处于没有DNA模板的非激活状态,想要更深入地理解端粒酶的运算机制,捕捉它在与DNA形成复合物的催化状态无疑具有重要意义。因为只有端粒酶结合端粒DNA后才会启动催化活性,进行端粒重复序列的精确合成;也只有在这个状态下,端粒酶的构象调控机制才会被完全激活,其核心结构域之间的相互作用才会显现出来。
周正洪教授团队在该领域更进一步,为了让端粒酶与DNA捆绑,他们设计了一种特殊的DNA探针,这段DNA包含了一些修饰过的核苷酸,可以像“分子胶水”一样牢牢黏住RNA模板。这种技术显著提高了端粒酶与这种DNA探针结合的力度。在加入这种DNA探针后,团队又向反应系统中加入了一种端粒DNA合成所需的核苷酸单体。在这种环境下,端粒酶就会像识别密码一样,特异性地结合DNA探针,并在RNA模板上合成了一小段端粒重复序列,进入激活的状态。
最后,团队使用一种“亲和过滤”的技术从复杂反应体系中精确提取出端粒酶-DNA复合物进行结构解析。最终,团队成功获得了端粒酶与端粒DNA复合体的三维结构信息。该复合物结构的解析使得科学家们在解开端粒酶密码的路上又前进了一大步,DNA的加入就像是这台大机器的一把钥匙,打开了通往核心机理的大门。
一、DNA激活端粒酶构象 实现精确配合
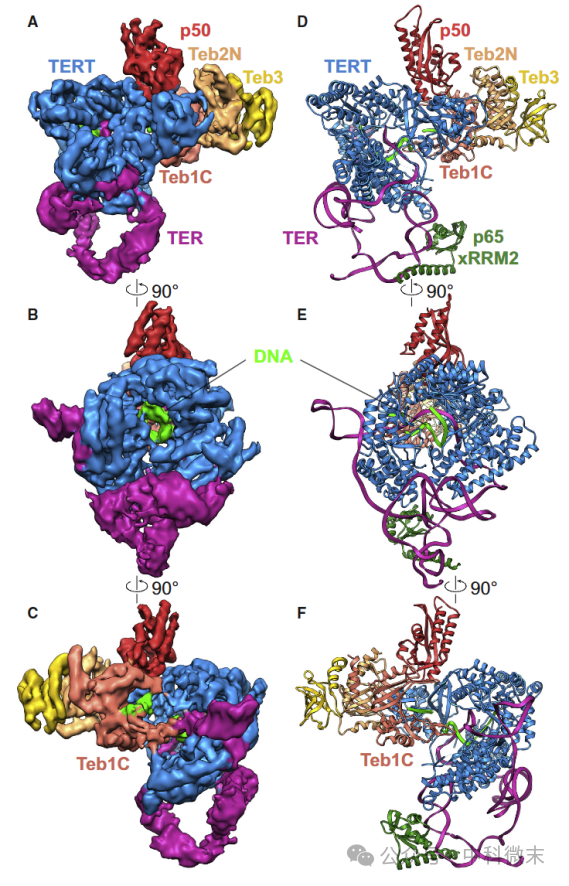
图1 冷冻电镜解析端粒酶与DNA的结合状态
首先,研究发现DNA的加入启动了端粒酶构象的显著改变(图 1)。TERT反转录酶与模板DNA形成完美配对,保证端粒DNA合成的精确性;TER RNA实现与催化核心的精确锁定组装,准备开始DNA链的合成。
值得注意的是,一个新的TRAP结构域与TEN域在端粒酶上折叠成“L”型构象(图 2),形成一个盖板覆在上方。这就像一个稳定的托盘,防止了RNA的移动,也保证每次DNA合成的精确终止位置。所以可以说,DNA的加入不仅开启了端粒酶的启动,还通过构象锁定的方式充分控制了酶的催化运作。
二、TERT与RNA精确配合驱动DNA合成
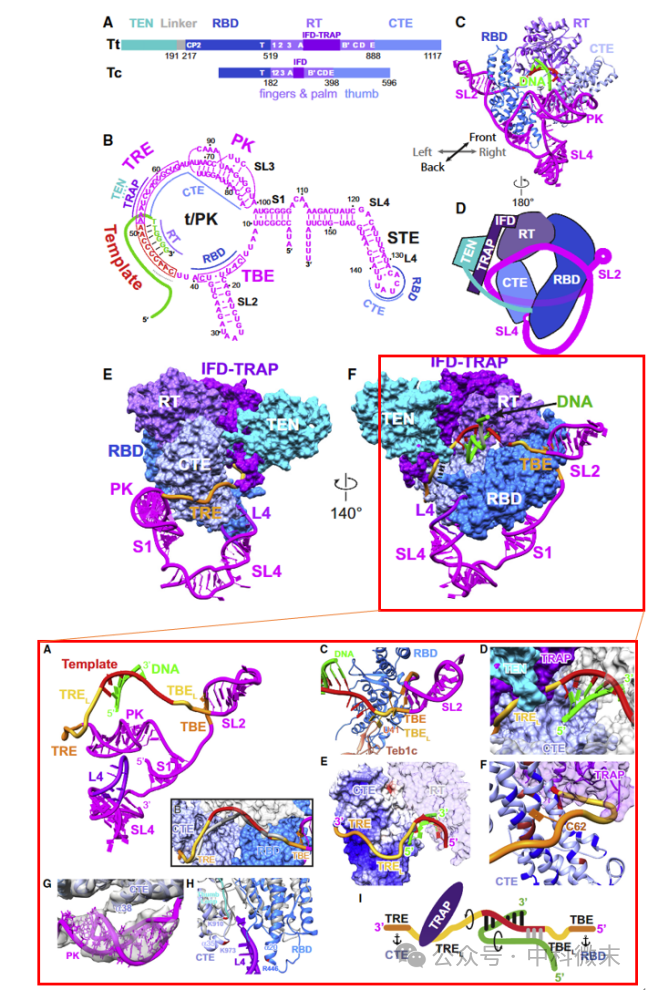
图2 TERT和TER构成一个相互锁定的催化核心结构
在端粒酶内部,TER RNA与TERT反转录酶又是如何协作的呢?从端粒酶-DNA结构我们可以明确看到(图2):
TER RNA围绕在TERT组成的环状结构外,通过多处作用控制DNA模板的精确识别。TER上的TBE、TRE等特定序列或结构都可与TERT不同结构域结合。这就像一根绳索上系着多个绳结,将RNA牢牢固定住,防止其随机漂移,确保DNA链合成的准确中止点。
另一方面,TRAP与TEN在TERT上折叠成新环,将TER RNA严格锁定在TERT环内侧,还与TRE形成直接作用。可以推测,在端粒DNA合成时,这会给TER RNA带来张力与拉伸。当每次合成产生一个端粒重复序列后,TER快速折叠回缩,将产物DNA从模版上释放,完成一个合成循环。
三、TRAP与TEN双重保证端粒酶反应精度
值得一提的是,在本研究中科学家还发现了TERT上的一个新的结构域TRAP(图2)。TRAP区与TEN结构域一起形成盖板,覆在催化部位上方。这使TEN不再直接接触DNA模板,而可能通过支撑TRAP结构发挥调控作用。
之前推送中我们已经讨论过TEN结构域的重要性,它加强了端粒酶反应过程性,也参与端粒酶的染色体招募。现在看来TEN的这些功能很可能是通过稳定TRAP构象来实现。事实上在本文中作者的突变体实验也支持了这一结论。
值得注意的是TRAP与TEN和催化部位之间还形成疏水相互作用,这类相互作用力度非常大。TRAP与TEN之间也存在庞大的界面。所以TRAP与TEN就像一个稳定的托盘,不仅固定住了TERT与TER RNA的精确结合,也为后续端粒DNA的合成创造了一个封闭的反应环境。
四、TEB与p50联手调控端粒酶的招募过程
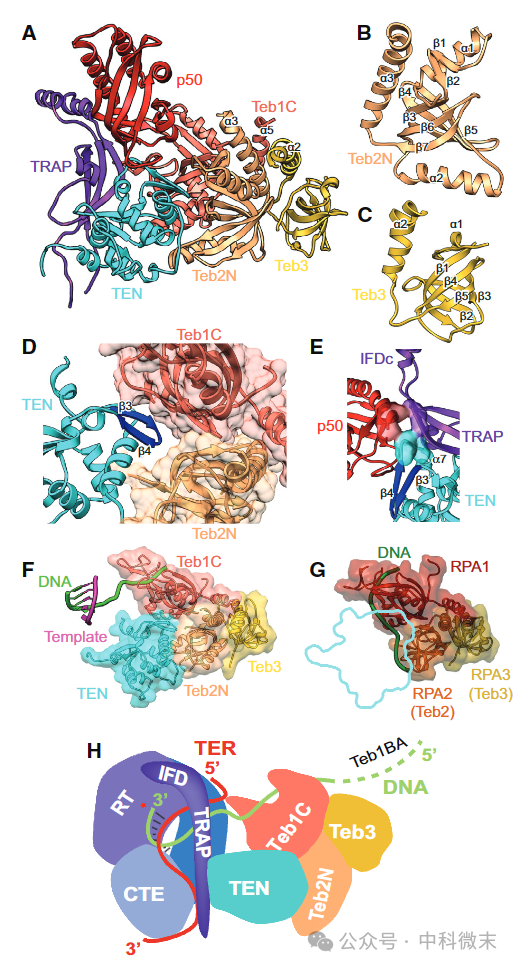
图3 TRET与调控性蛋白TEB与p50的结合模式
此外在四膜虫的端粒酶-DNA复合物结构中,作者还清晰解析了TEB与p50这两个调控性蛋白质组分的结构。他们主要位于外侧,与TEN结构域形成界面。这与人类端粒酶中TPP1-POT1激活TERT的方式类似,说明了TEB与p50也可能参与端粒酶的招募过程。事实上作者的突变分析也支持了这种可能性。
其中,p50中包含一个OB结构域,这在人类TPP1中也是存在的。而TEB蛋白则与新合成的单链DNA形成直接的相互作用,类似于人POT1的招募功能。所以TEB与p50很可能就是另一版本的“TPP1-POT1”,在增强催化活性的同时也负责将端粒酶招募到染色体末端。
本文作者通过比较发现,四膜虫的TEB与p50与人类端粒酶的TPP1-POT1高度类似。这不仅体现了端粒酶蛋白参与染色体保护的保守性,也支持两者可能具有相似的分子机制。
五、端粒酶机制研究又有新突破
本研究成功通过端粒酶与DNA形成的复合物解析出端粒酶-DNA的精确交互作用,是端粒酶结构生物学研究的又一重要里程碑。相比以往仅有端粒酶整体结构的信息,本文揭示的TERT与TER RNA、DNA模板之间的高度配合,明确阐释了端粒DNA合成反应的结构基础。同时也解析了TEB、p50等调控因子的坐标拓扑,支持它们在端粒酶激活与招募中的重要性。
当然,端粒酶调控的复杂性远不止于此。后续还需要进一步获得反映端粒酶与更多因子动态组装过程的中间结构,以绘制更加完整的端粒酶调控蓝图。中科微末作为国内结构生物学与人工智能技术的探索者,已充分认识到提供优质结构解析服务对于生命科学研究的重要意义。
中科微末依托自主研发的冷冻电镜技术,专注提供结构生物学研究服务,实现目标蛋白原子级高分辨率的结构解析。中科微末团队在冷冻电镜技术方面积累了大量算法与专利,可提供“高难度结构解析有解决方案,低难度结构解析更迅速、价格更优惠”的技术服务。展望未来,中科微末将继续致力于冷冻电镜技术的研发和创新,持续推出更多切合客户需求的结构解析解决方案。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


