今天为大家介绍的是来自Peter Wang 和Dean Ho 团队的一篇文章。

骨质疏松症是一种全球性疾病,该病导致死亡率、疾病负担和医疗成本显著增加。在美国,每年因骨质疏松症导致的骨折约有150万例,引起数十万次住院治疗。在人口迅速老龄化的地区,约30%的40岁及以上女性可能受到骨质疏松症的影响。亚太地区国家寿命的延长使得骨质疏松症和其他骨病成为需重点关注的问题,以减少医疗成本并降低患者的死亡率和疾病负担。开发安全有效的治疗方法是解决这些问题的关键策略之一。为了开发治疗骨病的潜在干预措施,长期以来的一个障碍是识别出能够维持骨髓间充质干细胞(BMMSCs)干性的临床可操作药物。由于BMMSCs在骨组织再生和稳态中的作用,保持其干性一直是骨病有效治疗方法开发中的一个重点。以往的方法包括激素治疗或抑制骨吸收治疗,但这些策略并未解决干性的核心问题。其他解决干性的方法包括细胞因子治疗和基因编辑。此外,治疗骨病的安全、有效之外,其可获取性和可负担性也是需要考虑的关键属性。
在《ACS Central Science》期刊的论文中研究人员利用深度学习(DL)平台快速确定了一种潜在的骨质疏松症药物候选物。该研究使用称为深度学习功效预测系统(DLEPS)的深度学习平台,平台通过利用药物相互作用与转录组的相关数据来运作。这些信息随后可用于针对差异表达基因(DEGs)进行额外评估,以产生一个效力评分,来优先进行药物测试。为了进一步了解这个效力评分的开发,研究使用RNA测序评估了从出生后第一天到6-8周大的成年小鼠,在衰老过程中哪些DEGs被下调。DLEPS从一个包含12,328个基因的数据集产生排名,预测DEG逆转以保持干性。从这个数据集中,通过整合DEG的上/下调分析生成了一个分数,以优先评估进一步的化合物。DLEPS识别出二氢青蒿素(DHA)是一个值得进一步评估的有希望的药物。向人骨髓间充质干细胞(hBMMSCs)中添加0.1 μm DHA能增加OCT4和SOX2的表达。值得注意的是,在培养基中加入DHA能持续5代细胞增加OCT4和SOX2的表达。
为了深入了解DHA增强干性的机制,团队进一步研究了组蛋白去乙酰化酶(HDAC)和组蛋白乙酰转移酶(HAT),因为这些酶的水平与非骨质疏松症小鼠显著不同。考虑到之前报道的与DHA类似的化合物在其他细胞类型中上调H3K9乙酰化的作用,研究进一步评估了DHA在调节推动干性的基因方面的作用。在一系列HAT(GCN5, P200, PCAF)和HDAC(SIRT6, HDAC1, HDAC2, HDAC8)酶中,DHA处理后GCN5的表达增加了1.5倍,并在骨质疏松BMMSCs中伴随着H3K9乙酰化的增加,这与体外发现相符。此外,在持续DHA处理(第8代)后敲除GCN5降低了干性标志和成骨能力的表达,而在这些细胞中DHA处理并未增加干性标志的表达。为了进一步提高DHA对骨骼的定位输送,研究团队利用与阿仑膦酸(ALNs)结合的介孔硅纳米粒子(MSN),后者能够靶向骨组织,形成MSN-ALN载体。当装载DHA后,MSN-ALN载体在骨质疏松的小鼠中显著改善了骨架构和骨量保持,与对照组相比有显著提升。值得注意的是,由于之前研究显示ALNs能减缓破骨细胞功能,人们认为MSN-ALN载体与DHA的结合进一步抑制了破骨细胞活性。总体而言,装载DHA的MSN-ALN载体也大大增强了未经修饰MSN-ALN的成骨细胞功能,展示了DHA装载纳米粒子持续评估的有前景的道路。
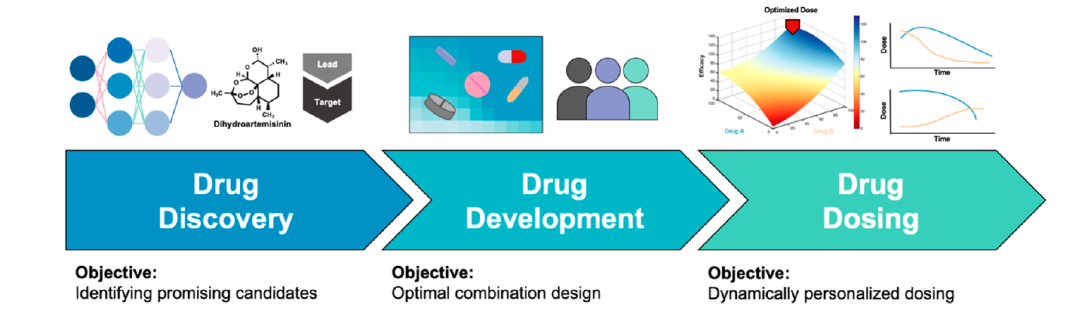
图 1
这项工作代表了深度学习在快速药物发现中角色的重要验证。在评估人工智能(AI)驱动治疗的更广泛角色时,重要的是要注意,药物发现只是包括药物开发(涉及药物组合设计等因素)和药物剂量计算在内的更大的药物优化工作流程的一部分(图1)。作为一个完整的工作流程,这三个部分可以深刻影响临床操作性和患者对单药或联合方案的持续反应。
在更广泛的AI语境中扩展深度学习的使用,以快速发现和推荐进一步评估的化合物,已经开启了通往更广泛潜在药物候选物的大门。为了妥善推进这些有前景的候选物,利用真正的优化找到适合的联合疗法伙伴可能是必不可少的。这在肿瘤学、心脏病、糖尿病、传染病等其他病症的治疗中尤其如此。由于AI/DL预测的疾病管理应用,天然化合物受到越来越多的关注。随着这些化合物的进一步评估,朝向临床前和潜在的临床研究,可能需要联合方案来实现其临床显著效果的全部潜力。虽然作用机制(MOA)和药物敏感性测试传统上用于组合设计,但AI的使用可能发现不可预测或未预见的相互作用,这些相互作用可以显著增加治疗效果。为了实现这一结果,需要探索大量的参数空间,即使是10种药物每种药物研究10个剂量水平也会导致数十亿种可能的组合。这将排除常规的迭代实验。幸运的是,新兴的基于AI的策略能够通过配对前瞻性实验与已建立的优化方法来探索这种规模的参数空间,从而产生全球优化的药物组合。例如,最近的工作包括解决SARS-CoV-2药物开发、患者血癌和抗微生物耐药性等问题。此外,新开发的深度学习模型DrugCell模拟了人类癌细胞在用药物治疗后的反应,并随后预测可能改善治疗结果的协同药物组合。
在药物开发工作流程的环节之后,接下来是临床前和临床药物剂量的优化。重要的是,一旦通过深度学习(DL)发现的药物候选物得到验证并且开发出联合方案,优化剂量可以对候选药物的临床效果产生深远影响。传统方法是通过增加剂量直到达到最大耐受剂量(MTD)来定义剂量优化。然而,新兴策略表明,真正优化的剂量是一个动态过程,治疗应随着患者状况的变化而进化。具体来说,剂量调整应该横向调节,以持续为患者带来最好的结果。这是因为药物协同作用依赖于剂量、时间,并受到个体患者反应的影响。在DLEPS工作中,MSN-ALN载体和DHA之间可能存在相互作用,共同改善抗骨质疏松的结果。
最近的研究表明,可以通过大幅减少剂量来维持人类实体癌症的稳定状态。此外,进化动力学已被用来减少人类前列腺癌治疗所需的总药物剂量。考虑到骨质疏松症和其他骨病的与年龄相关的特性,根据生理和疾病变化调节剂量(这些变化在年龄增长过程中不可避免地发生)可能有助于延长疗效。DLEPS工作可能对促进可及且持续的干预措施以对抗与年龄相关的疾病,使健康寿命与生命寿命一致(即人的健康持续时间与生命持续时间相匹配)发挥重要作用。
像DLEPS这样的研究代表了将AI/DL识别的化合物推进到临床相关验证的有前途的一步。特别是,扩展潜在药物的范围以解决随年龄增长而增加的疾病,增强了用于增加健康寿命的干预策略的范围。这些在当今世界的许多地方都是特别关键的需求。
原文链接:
编译 | 曾全晨
审稿 | 王建民
参考资料
Wang, P., & Ho, D. (2023). Deep Learning and Drug Discovery for Healthy Aging. ACS Central Science, 9(10), 1860-1863.



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


