

如果杨森活在当下,要达到他此前的成功几乎是不可能的,甚至没有机会开始。
1953 年,27 岁的保罗·杨森 (Paul Janssen) 父母的比利时药品进口公司三楼建立了实验室,并由此开启了杨森的发展之路。
20世纪 50 年代到 90 年代,Janssen和他的团队开发了70多种新药,其中许多药物至今仍在使用。

Paul Janssen 在实验室
对比如今的药物科学家甚至没有将一款药物推向市场就面临着退休。
今天发现和开发药物的成本比上世纪50年代高出几个数量级。尽管如此,进入临床试验的药物和上市药物相比,成功率并没有提高。
究竟发生了什么变化?
有人怪罪于FDA等监管机构设置了重重阻碍,有人则指责大型制药公司不思进取,只想着吃老本。
实际上,生产力危机是几十年来药物发现和开发逐渐变得越来越困难和昂贵的结果。
那么,为什么当初一个小小的公司能够吊打现在的制药巨头呢?
 保罗·杨森和“传统”药物发现兴起
保罗·杨森和“传统”药物发现兴起
在杨森(Janssen)之前,大多数药物制剂都是天然产物或已知化合物。
例如抗生素发现的“黄金时代”,上世纪40年代开始,到50年代中期达到顶峰,几乎每年都有新的抗生素类别被发现。
天然产物富含生物活性化合物,即使在今天,很多新药仍然来源于大自然。合成有机化学极大地扩展了可以探测的药物分子的空间,并使药物发现过程的工业化成为可能。
尽管人工化学合成出现在 1800 年代中期,但直到 20 世纪中叶,化学合成和分析技术才成熟到足以广泛用于工业药物发现。
Janssen的创新之一是合成和测试新药生物活性的结构化过程。Janssen采用了一种相对简单的过程,即在具有已知活性的分子的易于修改的中心核心周围交换分子构建块。
通过这种方法,Janssen的团队快速迭代并构建了一个标准化组件库。Janssen如同进入了处女地,在开始的一年内,Janssen和他的团队已经合成了大约500种新化合物。
1958年,Janssen的团队发现了氟哌啶醇。氟哌啶醇是一个项目的副产品,该项目旨在通过调整哌替啶(一种类似于吗啡的合成止痛药)来开发更有效、更少成瘾的止痛药。在迭代哌替啶的过程中,Janssen的团队观察到,这种新化合物特别有效果。
在这一发现之后,项目团队将重点转移到优化化合物的抗精神病特性,最终确定氟哌啶醇作为在人体中试验的候选药物。
到 1959 年,在首次合成后大约一年,在精神病房进行了短暂的临床试验后,氟哌啶醇在比利时广泛使用。两年后,西欧的绝大部分地区也开始使用氟哌啶
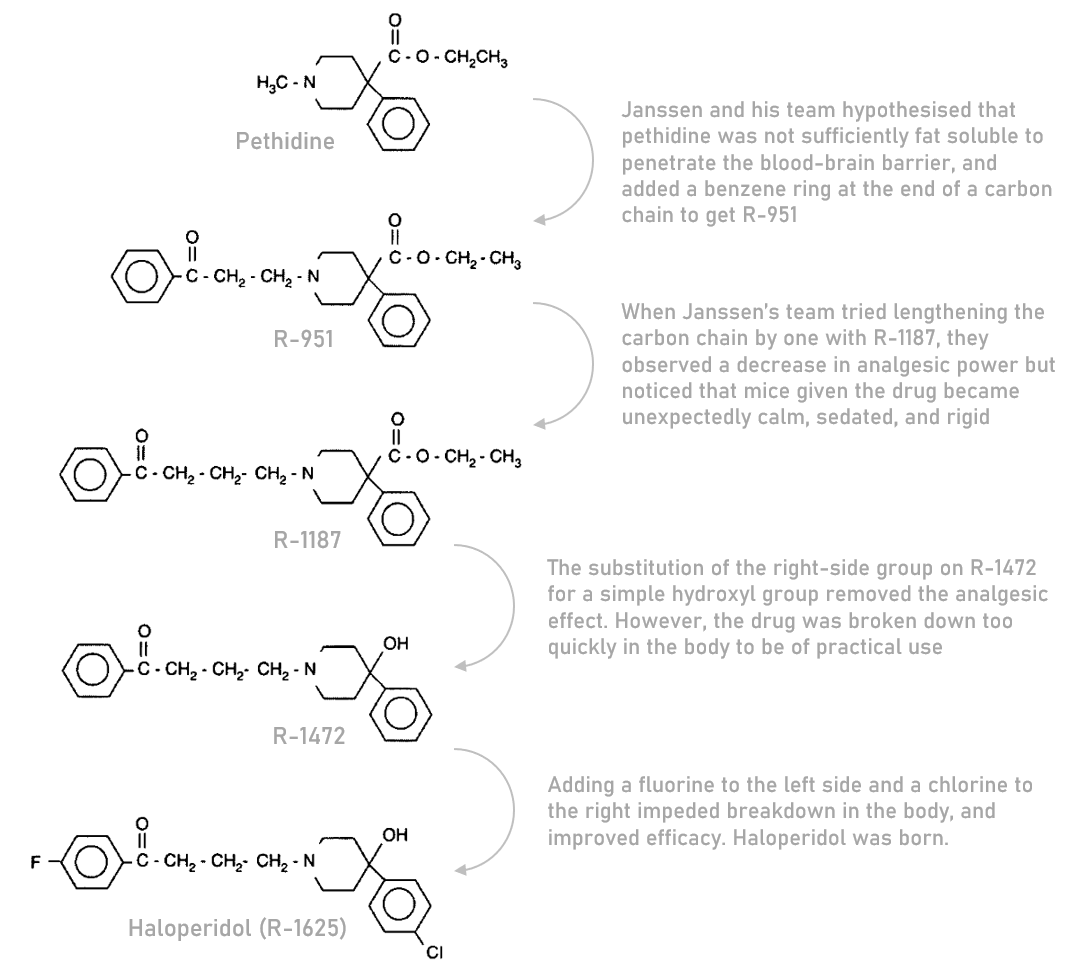
设计氟哌啶醇的过程作为药物合成的一个例子
与氯丙嗪(市场上第一种抗精神病药)相比,氟哌啶醇的镇静副作用更少,因此迅速被精神科医生采用。
尽管有更多的选择,时至今日许多医生仍然会使用氟哌啶醇。
 今天如何发现和开发药物
今天如何发现和开发药物
在今天,氟哌啶醇的快速发现和实际应用几乎不可能复制。我们已经进入了一个漫长、低效、昂贵且可能失败的药物发现和开发过程。
如今,将药物推向市场的标准流程可以分为四个连续阶段:药物发现、临床前开发、临床试验和监管批准。
基础研究是药物发现的上游,通过丰富我们对疾病生物学的基本理解和寻找新的药物“靶点”做出贡献。大多数基础研究都是在学术界进行的,但制药公司也会涉及。
基础研究有助于发现药物“靶点”,这也是靶向药时代最重要的知识。
Janssen当时不知道,氟哌啶醇通过阻断大脑神经元上的多巴胺受体来发挥其作用。多巴胺受体现在是精神分裂症的一个公认的靶点。
药物发现主要通过筛选获得:主要为高通量筛选和表型筛选。筛选出来的分子只是进一步优化工作的起点。
正如Janssen对氟哌啶醇所做的那样,化学家们会对结构进行调整,直到他们得到令人满意的“主要候选”分子。活性药物成分可能需要与其他化合物结合使用,使其更容易给药或帮助身体分配和代谢药物。例如,司美格鲁肽通常通过注射给药,因为如果它是口服的,它就会被分解或无法穿过肠壁。
一旦开发出主要候选药物,它就会进入临床前开发阶段。目标是了解这种药物在体内的作用,并证明它足够安全,可以进行人体试验。
临床前开发意味着将药物用于细胞培养物和动物,结果是了解与药物相关的风险和副作用,药物如何在体内代谢和分布,以及人体服用的合理安全剂量范围。
在候选药物被批准进行人体测试后,临床阶段就开始了——首先在人体中测试药物的安全性,然后是有效性。通常,I期试验的重点是安全性和寻找合适的剂量,通常是在健康志愿者中;临床II期,建立患者疗效的初步证据;III期在更大的患者样本中确认疗效,并收集可靠的安全性数据。
试验中收集的最重要的数据是被称为试验的“主要终点”的特定临床目标,例如生存率或疼痛严重程度量表的改善。失败的试验是指药物在主要终点上未达到目标性能水平的试验。主要终点和相关的统计分析计划在试验开始前指定——这(主要)阻止了药物开发人员在试验失败后人为地使他们的药物看起来更好而挑选数据。
一旦该药物在临床试验中显示出其有效性和安全性,并且监管机构确信它可以在规模上持续安全地生产,那么该药物将获得批准并获得特定“适应症”的上市许可。
 监管的逐步收紧
监管的逐步收紧
药物大多因为效果不足而失败,但大约四分之一的原因是出现临床前测试中没有发现的安全问题。
目前我们还不能从实验室小鼠等临床前模型中完美地推断出人类的安全性,这意味着人类必须暴露在一定的风险中才能测试出药物的安全性和有有效性。
这个过程有很大的风险,因为生物学不可预测。
2006年,TeGenero在的首次人体试验中遇到了这个问题,当时他们的候选抗体TGN1412过度刺激了试验参与者的免疫系统,导致细胞因子风暴,导致六名以前健康的志愿者因多器官衰竭而住院,一名患者失去了手指和脚趾。
尽管在临床前实验中没有副作用的迹象,给药剂量比动物的安全剂量低500倍,并且在临床前研究或制造过程中没有明显的缺陷,但这种情况还是发生了。
在临床前测试期间,我们尽最大努力确保试验志愿者的安全,尽管风险永远无法完全消除。在试验参与者和更广泛的社会愿意接受的风险与制药商证明安全性的监管负担之间,存在着自然的权衡。
这也延伸到上市后阶段。临床试验通常规模太小,无法发现罕见的副作用,例如血栓的风险(每百万剂报告3.2个),最终使强生COVID-19疫苗被停止生产。现代监管妥协是通过一系列安全丑闻达成的,每一起丑闻都让监管逐步收紧。
与之相对的是,1950 年代之前,该法规还处于萌芽阶段:它的重点是防止销售欺诈性、不纯或掺假的商品,或者仅限于特定的疾病或产品。
在美国,有100多人因摄入溶解在有毒的二甘醇而死亡。这导致了美国 1938 年《食品和药物法案》的通过,该法案要求药物开发商在上市之前向 FDA 提交证据,证明其产品的安全性。
而沙利度胺事件的发生,直接导致了1962年Kefauver-Harris法案的通过,建立了现代新药审批的标准。
自 1960 年代以来,药品监管机构一直试图在那些认为监管过于严格的人和那些认为监管机构过于宽松并让不安全的药物进入市场的人之间达成妥协。
Sam Peltzman等经济学家持另一种观点认为,1962年的修正案提高了开发新药的成本,并设置了障碍,对公众的伤害更大。
加速批准法规允许药物在解决严重或危及生命的疾病且没有良好治疗方法的情况下根据替代终点获得批准。
然制药企业可以通过验证性上市后试验来确认有效性和安全性。一段时间后,其他地区也采用了类似的途径,例如EMA的有条件上市许可。
替代终点不是直接衡量标准,但它们是旨在预测这些结果的衡量标准。替代物的优点是,它们通常比标准终点更快、更容易或更可靠地测量。
癌症试验可以评估肿瘤大小的变化作为替代物,而不是患者生存的最终有意义的终点;心血管试验可能会关注胆固醇水平或血压。
监管和社会对风险的容忍度似乎随着时间的推移而下降。我们可以看到这方面的例子,例如扑热息痛具有止痛功效和肝损伤风险,如果今天被发现,就不会得到监管机构的批准。
然而,竞争环境是不公平的:在公众、媒体和政策制定者的心目中,不安全药物的“看得见”危害往往压倒了延迟或阻止潜在有益药物进入市场的“看不见”危害。毕竟,死去的病人不能为自己辩护。
历史表明,监管对于保护患者免受不道德公司利用不安全或无用药物的侵害是必要的,但需要找到一个微妙的平衡点。
从长远来看,趋势是稳步对制药商施加越来越严格的限制。
如果监管继续收紧,整个行业将面临巨大的威胁,许多投资将会撤回。
 为什么现在的药物制造成本这么高?
为什么现在的药物制造成本这么高?
生物制药行业的花费巨大。
2022年,该行业在研发上的支出约为2000亿美元,是美国国立卫生研究院(NIH)480亿美元预算的四倍多。生物制药是经合组织国家中第三大研发密集型行业。
其中大部分支出用于临床试验和相关制造成本;大约50%的大型制药研发总支出用于I期、II期和III期试验,而临床前工作则为15%。
III期试验的后期失败比临床前小鼠研究的伤害要大得多。当一种药物进入第三阶段时,使其达到该阶段所需的工作可能已经耗费了五年或更长时间,甚至数千万美元。

药物发现和开发过程概述
临床试验之所以昂贵,是因为它们复杂、官僚且依赖高技能劳动力。现在,每位患者的试验费用高达10万美元,对于资源密集型设计,使用昂贵的标准护理药物作为对照,或在难以找到的患者(例如罕见疾病)的情况下,有时每位患者的费用高达30万美元甚至50万美元。
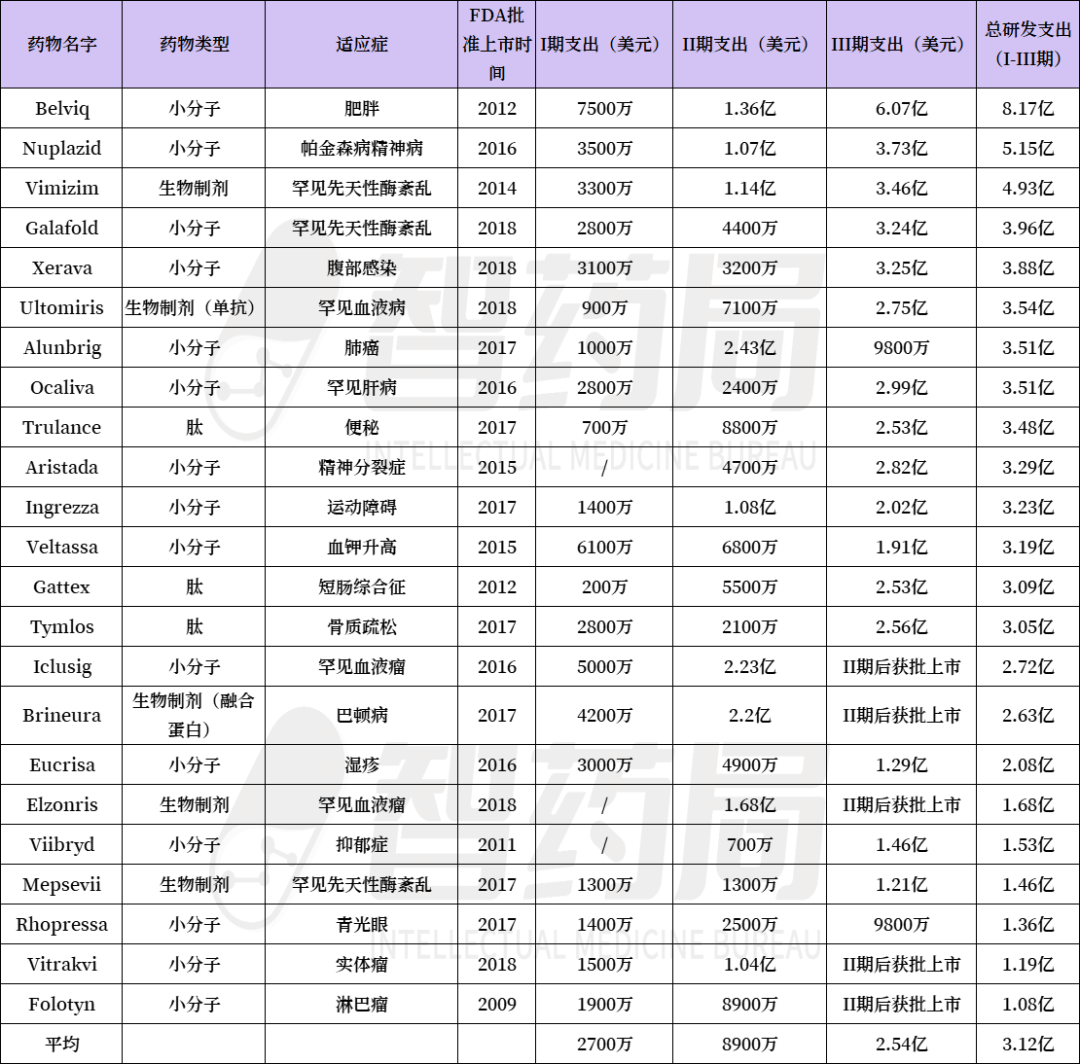
当这些成本加上其他研发支出时,一个拥有20-80名试验参与者的典型I期项目预计将燃烧约3000万美元。III期项目涉及数百名患者,通常需要数亿美元的支出。在心血管疾病或糖尿病等标准条件下进行数万名患者的临床试验可能花费高达10亿美元。
在过去的10年里,该行业在研发上花费的所有资金都在上涨。尽管生物制药研发支出持续增长,但我们还没有看到产量的成比例增长。行业研发效率——粗略地衡量为每十亿美元实际研发支出中FDA批准的药物数量,一直在下降。
这种趋势也被称为“反摩尔定律”,考虑到失败和通货膨胀的成本,该行业现在每一种批准的药物花费约25亿美元,而杨森在1953年成立时为4000万美元(按今天的美元计算)。
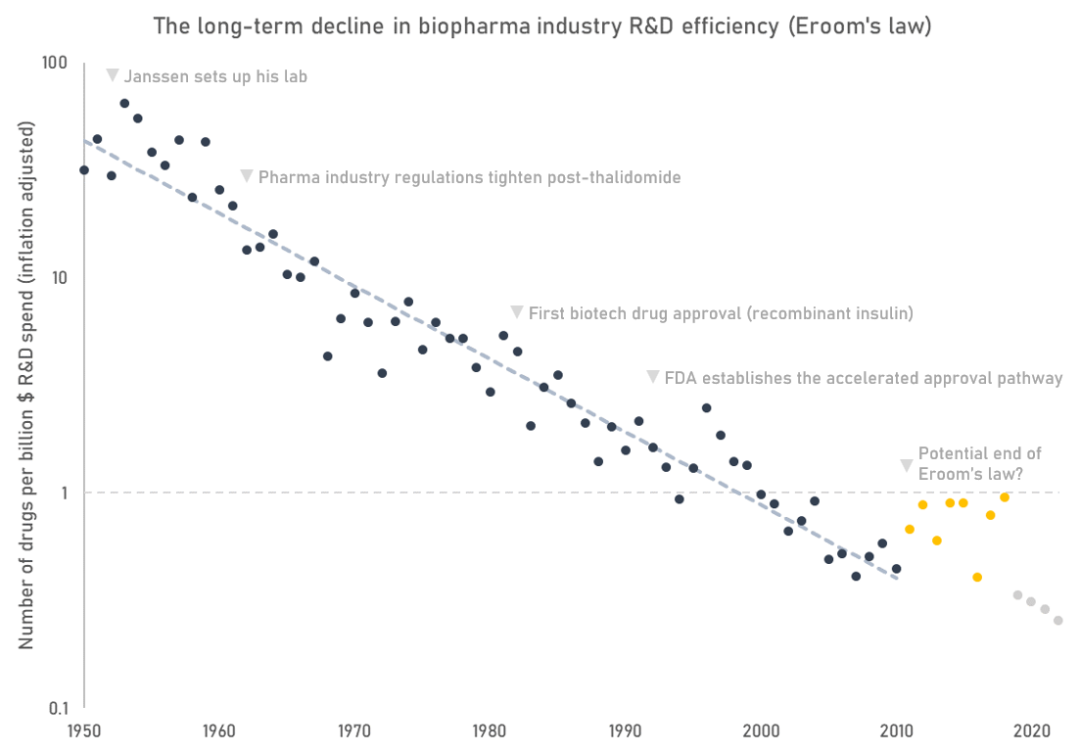
FDA批准的药物数量每十亿美元的实际研发支出遵循长期下降的趋势
药物批准数量只是一个指标。本质是我们的钱在质量和寿命方面得到了多少改善?
自 1980 年代以来,制药和生物技术行业的总盈利能力和投资回报率有所下降,这表明该行业提供的价值可能低于过去。估计行业投资回报率接近负值。
归根结底,研发生产力的下降影响了我们所有人,因为我们得到的药物比其他方式要少。
尽管我们花了比以往任何时候都多的钱,但真正的瓶颈不是找到结合和调节目标靶标的候选药物,而是找到真正有益于患者的候选药物。
几乎自相矛盾的是,尽管药物发现技术取得了巨大进步,但新药上市的速度在50年内几乎没有变化。
高通量筛选、新模型系统、机器学习和其他花哨的现代技术几乎没有改变这样一个统计数据,即每10个开始临床试验的候选药物中就有9个无法获得批准。
为什么行业正在花费越来越多的资源来保持大致相同的药物发现速度?
首先,正如我们在科学领域所看到的那样,新的想法越来越难找到。
学术研究人员比以往任何时候都多:1930 年代为 80,000 人,而今天美国为 150 万人,但我们并没有看到有意义的发现率成比例的增长。
这可能是因为想法本身就越来越难找到,也可能是因为科学的机构陷入官僚主义、僵化、追逐错误的指标,从而限制了个别研究人员的影响。
生物制药业务建立在基础发现之上。如果没有在疫情之前发现稳定冠状病毒刺突蛋白和增强免疫原性的方法,我们不太可能像现在这样快速获得有效的 COVID-19 疫苗。
与过去几十年相比,现在人们开始研究历史上被视为难以解决的靶点。现代蛋白质靶标更有可能是无序的,小分子结合的口袋很浅或不存在,或者难以相互作用。
然而,研发效率下降的更重要原因是,药物仅仅具有新颖性和安全性是不够的,它们还必须在现有的护理标准上有意义地改进,其中可能包括大量有效和廉价的旧药。
随着药物越来越难找到,进行测试它们所需的临床试验也变得越来越昂贵。今天的试验成本是试验规模更大、更复杂、在更多地点招募更狭义的患者以及比以前更耗费资源。
试验规模也越来越大。需要证明优于护理标准的益处意味着效应量会随着时间的推移而缩小,这意味着需要更大规模的试验具有足够的统计功效来区分新疗法和旧疗法。
目前心血管疾病的降脂治疗(主要是他汀类药物)非常有效,以至于PCSK9抑制剂(一类新型降胆固醇药物)在他汀类药物之上所取得的改进需要大规模的开发计划来证明。
例如ODYSSEY 试验显示阿利库单抗治疗与他汀类药物联合治疗可使死亡率相对风险降低 15%,招募了近 19,000 名额外心血管事件高风险患者,时间约为 5 年,成本约为 10 亿美元。
参与试验的研究中心越多,协调方案在各个研究中心之间适当执行、数据收集到良好标准以及药物根据需要分发到所有研究中心所涉及的后勤复杂性就越大,这都会增加成本。
由于行业内的大量重复工作,许多相似的药物追逐相同的靶点并争夺相同的患者,这加剧了招募的难度。这意味着没有一项试验招募足够的患者来进行试验,从而增加了所有药物的试验时间。
各种审批带来的官僚主义也延长了这个时间:选择场地包括伦理委员会的审查通常需要8个月的时间,各种各样的申请和知情同意书需要签署。
上世纪50年代,然而当Jassen开始临床试验的时候,还不需要这么繁琐的程序。那个时候还没有双盲试验,Jassen获得医生的认可和同意后,几天之内就可以给患者服用药物。
如今,开展临床试验所涉及的复杂性、官僚主义和巨额资金已经创造了一个自己的行业。例如CRO 和临床试验中心可以收取资金,几乎没有负面影响,并且不会被迫创新以改进流程。
进入壁垒和风险规避是如此之高,以至于它们可以阻止采用新方法,并获得足够的资金和规模来积极颠覆行业。
不仅仅是试验操作会消耗大量的时间和金钱。药物生产受到严格的药品生产质量管理规范 (GMP) 法规的控制,这要求开发人员在药物进行人体测试之前对一致性、效力、杂质和稳定性实施严格的质量控制。
生物制剂的兴起
近期生产率提高的另一个可能驱动力是生物药物的兴起。杨森生产的传统药物被称为“小分子”。与小分子不同,生物制剂是在生物体中生长的,而不是化学合成的。
1980年代,由基因泰克领导的重组DNA革命使蛋白质和肽激素等生物药物得以大规模生产。

基因泰克胰岛素团队及其生产工厂,约1978年
自 80 年代以来,与传统的小分子药物化学相比,生物技术行业的重要性相对增长。
随着 FDA 批准的份额增加,生物药物正在增加,截至 2022 年,已接近超过“传统”小分子。随着药物化学取代天然产物的发现,生物技术也将取代小分子药物化学。
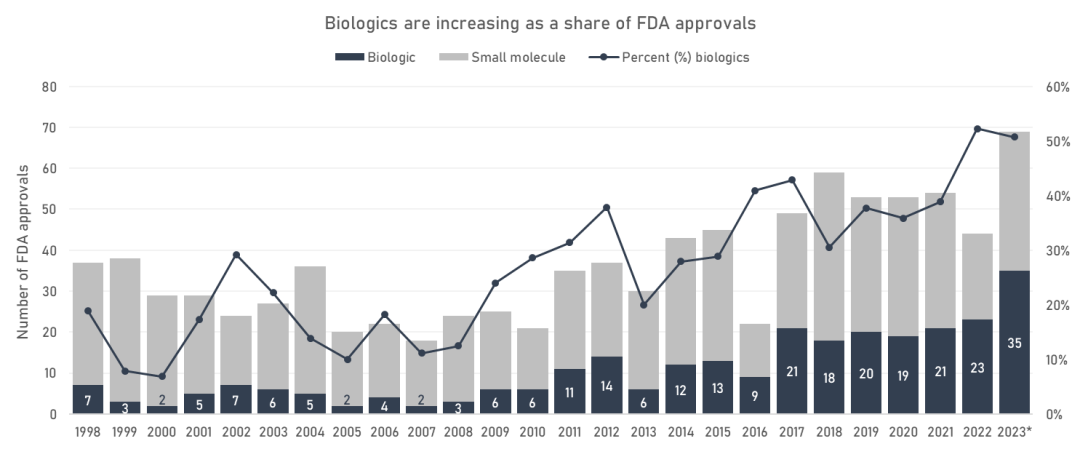
FDA对生物制剂和小分子的批准情况
迄今为止,最具治疗和经济意义的一类生物制剂是单克隆抗体。
FDA 于 2021 年批准了第 100 种抗体。在2022年收入排名前10位的药物中,有3种是单克隆抗体。
RNA疗法现在也开始发挥作用。小干扰RNA现在正找到多种临床应用。Inclisiran是一种单次注射,可强力降低PCSK9并降低胆固醇,只需每6个月注射一次,而阿利库单抗则每2周注射一次。
mRNA的适应性使得在病毒序列公开后,可以在两天内在计算机上设计出COVID-19疫苗。
如今,生物制剂主要重新利用自然界中已经存在的基因和蛋白质,并将它们重新添加到治疗环境中。
展望未来,生物工程工具箱继续扩大。下一个杨森可能是自然界中不存在的生物制剂的理性设计和工程的先驱。
 如何重振生物医学生产力
如何重振生物医学生产力
如果我们对反摩尔定律的趋于平稳持乐观态度,相信生物医学停滞并非不可避免,我们能做些什么来鼓励这种逆转继续下去?
归根结底,我们有三种方法可以充分利用我们未来的研究资金:
我们可以通过提高分子的质量来提高临床试验的成功率
我们可以通过放宽某些监管证据或制造标准,或提高临床试验的效率,使药物开发成本更低、
我们可以激励那些在未来有很高回报潜力的研发活动,比如基因疗法,即使目前开发相对不经济
提高临床试验的质量
我们不是缺少分子,更是缺乏对潜在疾病生物学理解的分子。因此扩大对改进的疾病模型的投资,这些模型能够更好地预测药物在人体中的表现。
沿着这些思路,罗氏在2023年5月建立了人类生物学研究所(IHB),专注于人类类器官,这些模型系统有可能有意义地提高临床前到临床的转化成功率。
人工智能的最新进展有望最终渗透到生物应用中。尽管许多业内人士对此持怀疑态度,但是人工智能模型已经被多个团队用于药物发现中。
虽然AlphaFold在蛋白质结构预测方面取得了成功,但深度学习系统和训练数据需要时间才能成熟到足以用于预测人类安全性和有效性的真正增值任务。
尽管有足够的空间来提高临床试验投入的质量,但开发更好的药物仍将是一个固有的具有挑战性的科学问题。
降低药物开发成本
改变监管框架,根据未满足的需求,以原则性、一致的方式放宽审批标准。
降低开发成本的另一种选择是扩大加速批准和替代物的使用,并增加对新替代物的发现和验证的投资。
自该途径建立以来,这些领域也在患者预后方面取得了实质性进展。例如,乳腺癌的死亡率已经下降到一定程度,以至于转移性乳腺癌现在被一些人认为是一种可控的慢性疾病,Xeloda、Femara、Ibrance和Enhertu等多种重要药物获得了加速批准。
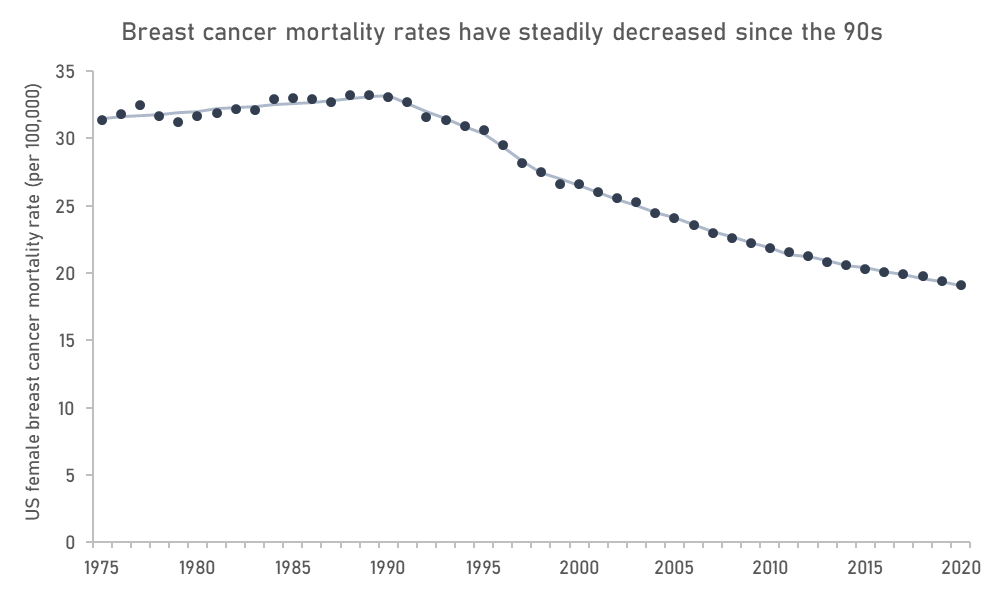
来自 SEER 的数据
因此,在采用更宽松的批准标准的同时,在未能及时确认其益处时,应与更严格地清除相关药物。2022 年 FDA 的改革是朝着这一目标迈出的一步,它授权该机构要求在加速批准之前进行验证性研究,并在验证性研究进展不足时加快退出。
更一般地说,如果监管机构在决策时能够更加可预测和透明,对行业有非常大的促进作用。在一项针对药品和器械行业专业人士的调查中,68%的人表示,FDA的不可预测性阻碍了新产品的开发。
复杂产品的制造要求也可能受益于开发早期标准的一些放宽。小分子的制造相对简单,但细胞和基因疗法很复杂,很少有人具备必要的专业知识。相对于更成熟的药物类别,细胞和基因疗法因制造问题而导致的开发中断很常见,随着公司收集进一步的分析数据,通常会将项目推迟一年或更长时间。
管理临床试验行为的GCP法规可以进一步调整为以患者为中心和研究者友好。不必要的文书工作应该被剥离,精简过多的安全报告表格,以删除不必要的信息并标准化。
鼓励不经济但有潜力的疗法
最后,我们应该支持具有潜在价值的技术。生物技术本质上是一个资本密集型行业,因此投资不足会导致浪费。
在过去的几十年里,大型制药公司不再优先考虑对内部早期药物发现的投资,转而采用外部化模式,即从生物技术公司收购药物和技术。
这种引进的方式已经被广泛使用,风险投资机构是生物技术生态系统的重要贡献者。
然而,这也意味着将早期资本配置的控制权拱手让给风险投资家,可能应用研究的资源不足。
通过将资本和专业知识分散到许多公司,可能会出现这种没有一家公司分配足够的资源和时间来充分投资开发基础技术。
扩大和集中对该领域创新者可以共享的能力的投资,有助于减少冗余支出,并推动这些下一代技术降低成本。
写在最后
从根本上说,提高生物制药行业生产力的方法是降低实验成本。
Janssen在他的研究中采用的那种快速迭代试错是进步的关键驱动力。与氟哌啶醇一样,我们许多最有影响力的药物都是偶然发现的。当实验成本低廉时,公司可能会愿意为更多的探索性研究提供资金。
另一方面,昂贵的开发和边际回报产生了一种基于会计的思维方式,这种思维方式降低了上行风险,有利于安全的增量投资。我们探索得越少,我们发现的就越少。
随着杨森公司的变化,整个行业也发生了变化。制药行业减少了对经济回报不高的疾病的投资。
扭转这种研发效率的长期下降是生物制药行业面临的最大挑战。
如果我们继续简单地对药品价格施加政策压力,而没有随之而来的开发成本或失败率的下降,那么随着投资者的退出,生物制药的进展将受到影响。
毕竟,有更简单的赚钱方式。
—The End—
推荐阅读







 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


