今天为大家介绍的是成都赜灵生物医药科技有限公司/四川大学华西医院生物治疗全国重点实验室陈俐娟教授团队在Journal of Chemical Information and Modeling上发表的文章Local Scaffold Diversity-Contributed Generator for Discovering Potential NLRP3 Inhibitors。成都赜灵生物医药科技有限公司成立于2019年,是一家专门从事创新药物研究及产业化的生物医药科技公司,构建了完整的新药研发体系,自主研发能力覆盖创新药物的靶点研究与机理验证、人工智能分子设计、临床前评价、CMC研究、临床方案设计与执行、新药注册等各个环节,打造了具有特色的创新药物发现平台。目前公司已获得5张临床试验批件,其中获美国FDA临床试验批件1张。成都赜灵建立了差异化并具有市场竞争力的丰富研发管线:1、治疗血液系统淋巴瘤化药Ⅰ类新药注射用甲磺酸普依司他;2、治疗骨髓纤维化Ⅰ类新药马来酸氟诺替尼;3、治疗自身免疫性疾病炎症性肠病(IBD)和类风湿关节炎(RA)的选择性JAK3小分子抑制剂药物ZL-82。公司核心品种甲磺酸普依司他和马来酸氟诺替尼在临床上已初步显示出良好的临床疗效,具有成为Best-in-Class和First-in-Class药物的潜力。

深度生成模型已被广泛应用于从头药物设计中。在当前分子生成的多目标优化模型中,当引入多个约束时,分子的骨架多样性会受到限制。为了提升分子骨架多样性,陈俐娟教授团队在此提出了一种局部骨架多样性增强的分子生成模型(LSDC),它可用于生成能够满足多种约束的先导化合物。与目前先进的方法相比,LSDC生成的核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)抑制剂更具多样性。文中展示了12个LSDC生成的分子,其中一些骨架是从未报道的。通过对选定骨架进行修饰和生物活性测试,发现了两种有效的NLRP3抑制剂A22和A14,IC50值分别为38.1 nM和44.43 nM。并且化合物A14的口服生物利用度非常高(F在小鼠中为83.09%)。这项工作有助于发现新型NLRP3抑制剂,并为AI生成算法与湿实验的结合提供了参考。
背景
深度生成模型已成为从头药物设计的重要工具。比较成熟的分子生成方法有使用循环神经网络(RNN)作为 SMILES 生成器,并通过迁移学习对其进行训练,RNN模型生成的新分子与训练集分子具有相近的化学分布。目前,已有几种用于多目标优化的分子生成模型(例如MCMG),当添加多个约束时,会导致骨架多样性受限。已有发表的工作是用来提升多目标优化任务中的骨架多样性,然而,这些模型关注的是分子的全局分布而不是局部骨架特征。因此,为了增强生成分子的骨架多样性,作者提出了一种局部骨架多样性增强的分子生成模型(LSDC),它可用于生成能够满足活性和类药性等多种条件的先导化合物。
NOD样受体是一种细胞内模式识别受体,在先天免疫系统中有重要作用。NLRP3是NOD样家族中研究较多的成员。NLRP3由N端的PYD(pyrin domain)、中间的NACHT(nucleoside triphosphatase domain)和C端的LRR(Leucine-rich repeat)多个结构域组成。NLRP3 已被证明可以被各种病原体和损伤相关的分子模式激活。当NLRP3被激活时,它能够通过与接头蛋白(adaptor)ASC以及下游的胱天蛋白酶caspase-1相互作用,导致NLRP3炎症小体复合物的形成,从而导致激活形式的 pro-IL-1b、pro-IL-18 和 Gasdermin D 通过 caspase-1 裂解。NLRP3 过度激活以及因此导致的炎症失调是许多炎症、自身免疫和神经系统适应症的一个关键方面。因此,因此,NLRP3已成为炎症性疾病的治疗靶点。本文比较了RNN、MCMG和LSDC 这3种深度学习模型在生成NLRP3抑制剂任务中的结果。
方法
LSDC使用Transformer算法、知识蒸馏RNN模型以及局部骨架定制函数和多目标优化的强化学习策略构建而成。作为先导化合物发现的全流程生成模型,LSDC通过提取局部特征以提高骨架多样性。LSDC首先通过Transformer算法进行模型预训练和知识蒸馏RNN模型来拓展训练集,以扩大生成分子的化学空间;其次,加入活性、类药性和可合成性等约束条件来训练强化学习模型,以满足小分子的多目标优化;最后,由局部骨架定制函数对小分子进行局部特征采样,计算生成分子与高活性NLRP3抑制剂的局部骨架相似性,当相似值高于设定阈值时得到强化学习惩罚分数,并且同一类骨架分子仅保留固定数目,以避免模型陷入局部最优。作者通过与先进的生成模型进行对比,将LSDC靶向NLRP3生成潜在抑制剂分子并进行虚拟筛选。
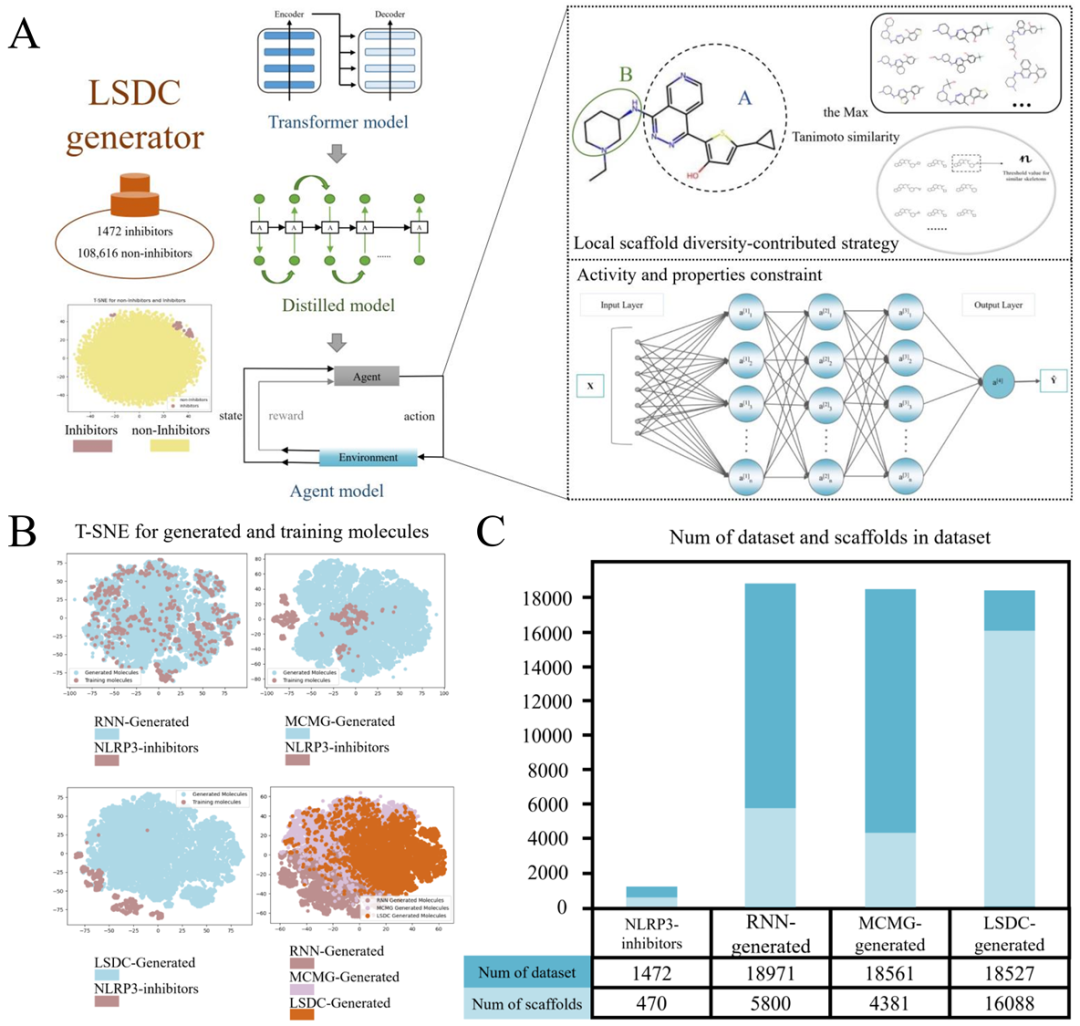
图1. LSDC流程图及3种模型生成结果对比
结果
文章选择从头设计NLRP3抑制剂。通过比较选择LSDC生成的18527个分子进行药效团筛选和聚类分析,最终得到100个化合物。文中展示了12个满足SAR规则的全新骨架(A1到A12),根据药化经验对其中2个骨架(A1和A2)进行结构衍生,通过合成实验得到了10个化合物。骨架A1衍生了A13到A19号分子、骨架A2得到了A20号到A22号分子。通过生物实验测试合成的10个分子及阳性化合物MCC950。初选化合物A14、A17、A18、A19、A20和A22化合物均具有很好的NLRP3炎症小体抑制效果,其对IL-1β的IC50分别为44.43nM、148 nM、98.86 nM、179.9 nM、124.8 nM和38.1 nM。进一步通过药代动力学实验证明化合物A14口服暴露量较高,具有很高的口服生物利用度(在小鼠中F为83.09 %)。
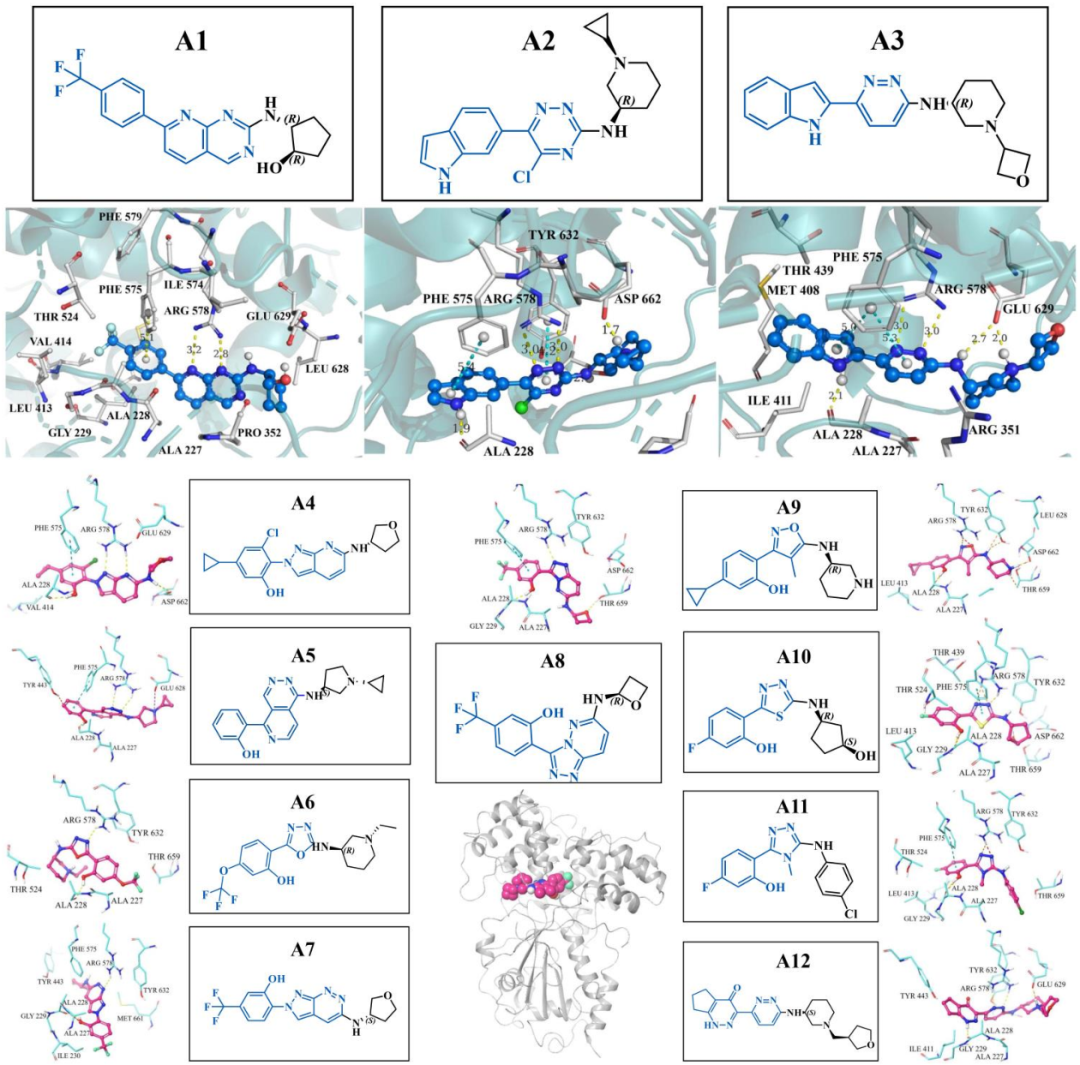
图2 LSDC生成分子和NLRP3蛋白的对接结果(PDB ID:7ALV)
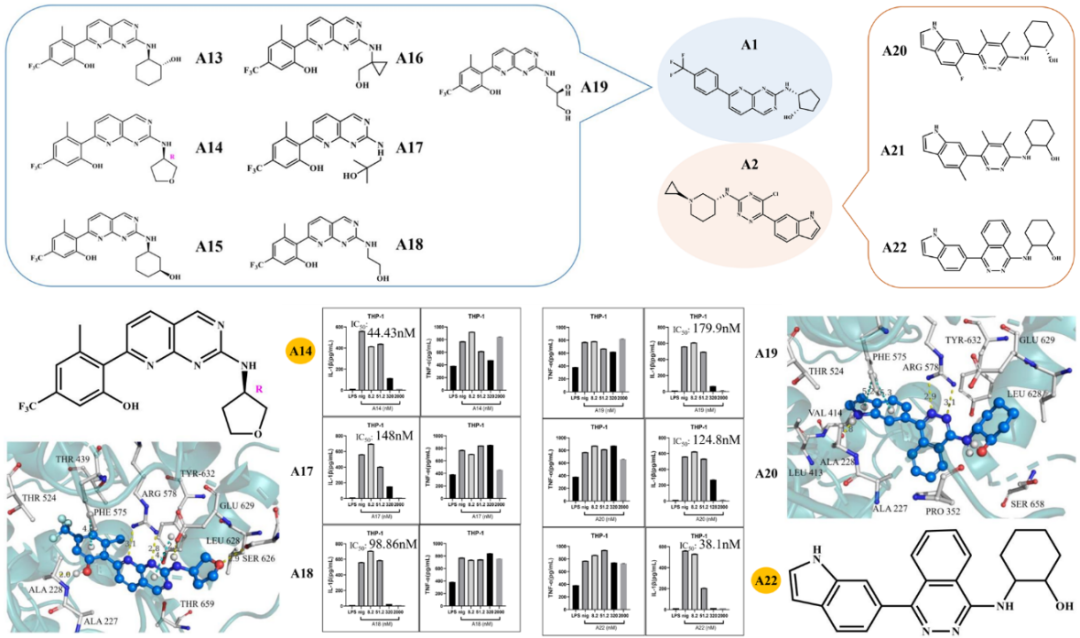
图3. 化合物衍生及生物活性测试
总结
目前,大多数深度生成模型主要集中于全局分子结构的概率分布采样上,而对局部骨架特征的关注有限。文章提出LSDC来生成更具多样性的先导化合物,这项研究有助于发现新的NLRP3抑制剂。此外,也可以作为AI生成模型与湿实验结合的参考。对于Transformer和RNN算法,输入更大化学空间的样本会映射更多数量的标记,最终增强骨架多样性。除了文中讨论的算法考虑因素之外,还在未来的输入中整合更多的NLRP3抑制剂数据,以增强模型生成的多样性。
参考资料
Bo, W., Duan, Y., Zou, Y., Ma, Z., Yang, T., Wang, P., Guo, T., Fu, Z., Wang, J., Fan, L., Liu, J., Wang, T., & Chen, L. (2024). Local Scaffold Diversity-Contributed Generator for Discovering Potential NLRP3 Inhibitors. Journal of chemical information and modeling, 10.1021/acs.jcim.3c01818.



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


