今天为大家介绍的是来自Xiaoyuan Chen和Shuyang Zhang团队的一篇论文。

近年来,对罕见病生物学基础的深入理解以及如核酸药物这样的治疗平台的进步,促进了对罕见病药物的研发(R&D)的增加。政府激励措施和监管举措也发挥了关键作用,比如1983年美国的孤儿药法。在过去的十年里,中国也推出了促进罕见病药物研发的政策。2017年国家药品监督管理局(NMPA)发布的《关于鼓励药品创新优先审评审批的意见》中,指定了18类优先审评审批的药品,包括罕见病药物,这加速了罕见病药物和其他迫切临床需求药物的批准。这一政策在2019年的《中华人民共和国药品管理法》和2020年的《药品注册条例》中得到了加强。最近,NMPA在2022年发布的《罕见病药物临床研究与开发指南》中,提供了关于罕见病药物试验设计的详细建议。
为了研究这些变化在中国与全球研发方面的影响,作者分析了过去十年中中国和全球在临床前和临床开发阶段的罕见病治疗药物的管线,以及截至2022年底的状态。
罕见病研发的格局
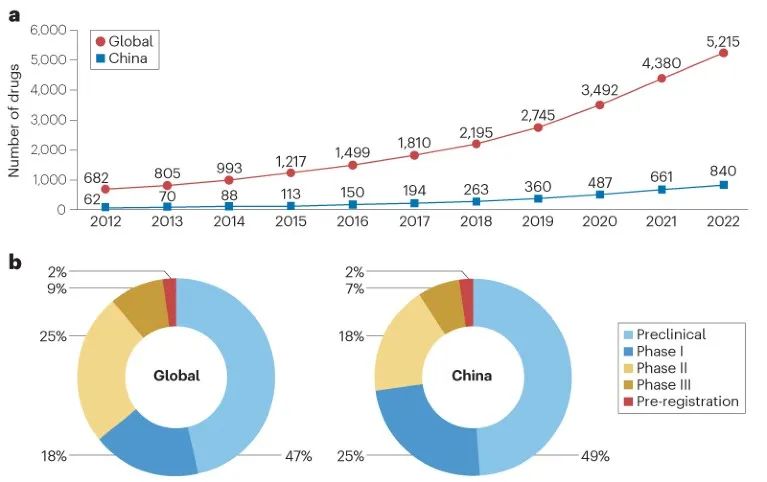
图 1
总体趋势:在这十年间,全球和中国针对罕见病的药物在临床前和临床开发阶段的数量都有所增加,如图1。到2022年底,中国共有840种罕见病药物正在开发中,其中412种(49%)处于临床前阶段。对于所有获批的研究性新药(IND)申请,有206种(25%)药物进入了I期,152种(18%)进入了II期,56种(7%)进入了III期,14种(2%)处于预注册阶段。相比之下,全球共有5,215种罕见病药物在开发中,各阶段的分布相似。在过去五年中,中国罕见病药物研发管线的增长显著,年均增长率为34%,相较之下全球管线的增长率为24%。这一增长与中国自2017年起推行的医疗卫生体系改革的时间一致。
治疗领域:对所有罕见病药物的分析表明,全球和中国最活跃的治疗领域是肿瘤学,占全球管线的43%和中国管线的71%。尽管中国首批和第二批罕见病名单中包含的罕见肿瘤种类很少,但这一类别涵盖了一大组发病率低但预后不佳的病症。在肿瘤领域中,中国和全球管线中排名前六的病症类似但不完全相同。非霍奇金淋巴瘤、胰腺癌、骨髓瘤、急性髓系白血病和卵巢癌在两个前六名单中都有出现,而全球前六名单中的胃癌在中国并不被认为是罕见肿瘤,这与这些疾病的发病率不同有关。除了肿瘤学外,全球其他最大的治疗领域包括神经学(12%)、呼吸系统(8%)、消化/代谢(7%)和免疫疾病(6%)。而中国的重点领域则不同。值得注意的是,中国所有在研药物中只有4%用于神经疾病,2%用于消化/代谢疾病,这些领域可能存在大量未满足的医疗需求。近年来,中国国家罕见病登记系统支持的神经和代谢罕见病临床队列正在收集更多信息,以促进这些领域的药物开发。此外,与全球和中国前六大罕见癌症类别相似的情况不同,前六大非肿瘤类罕见病类别相当不同。特发性肺纤维化和肌萎缩侧索硬化症是两个前六名单中共有的病症,这部分是由于非肿瘤类罕见病的发病率不同。对于一些活跃的非肿瘤类罕见病,如血友病,中国已有几种由跨国公司提供的批准药物,而中国正在开发的这类药物主要由国内公司赞助。
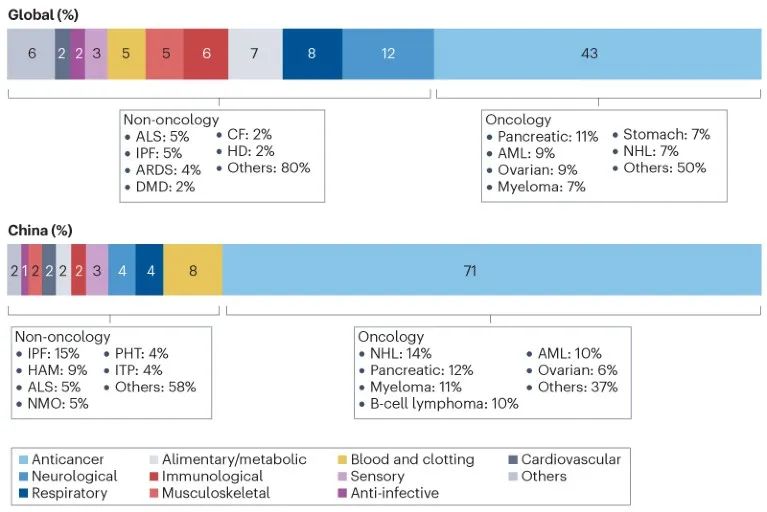
图 2
药物和赞助类型:在全球范围内,生物药物占罕见病药物总管线的近一半(49%),其中蛋白质(20%)、细胞(16%)和核酸(9%)药物为前三大类别(图2)。在中国,生物药物占管线的57%,其中细胞(26%)和蛋白质(26%)药物占了绝大部分,核酸药物虽然是下一个最大的类别,但只占3%。鉴于全球核酸平台的持续进展及其对罕见病的高度相关性,基于这些平台的疗法可能是中国罕见病药物管线增长的一个有希望的机会。在全球范围内,15%的药物由学术机构赞助开发,而在中国这一比例为25%。化学药物占全球该类药物的47%,其次是细胞和蛋白质药物,分别占24%和21%。相比之下,在中国,由学术机构赞助的最大类别药物是细胞药物(48%),其次是化学药物(28%)和蛋白质药物(18%)。随着诸如细胞疗法这样的下一代技术在罕见病研发中扮演重要角色,中国的学术机构在这些疗法上与产业赞助商建立了合作关系,这也可能是中国罕见病药物管线快速增长的一个领域。
展望
中国对罕见病药物开发的支持政策已经促进了这一领域的医疗创新。这可以从过去五年中国罕见病药物管线中代理药物数量的迅速增长中看出(图1)。与全球管线的比较突显了治疗领域、药物类型和学术机构的转化研究方面的不同重点。这些观察结果可以为进一步的政策制定和投资提供信息,以满足未满足的医疗需求,加强薄弱环节,避免在同一领域多个代理药物的聚集,并促进中国学术机构与产业赞助商之间的合作。随着中国政府在这一领域持续提供激励和监管改革的帮助,预计未来罕见病药物开发将持续增长。
编译 | 曾全晨
审稿 | 王建民
参考资料
Rui Chen, Sen Liu, Jiashu Han, Shuhua Zhou, Yang Liu, Xiaoyuan Chen & Shuyang Zhang (2023). Trends in rare disease drug development. Nature reviews drug discovery.



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


