
制药和医疗器械行业的人工智能监管框架正在发生重大变化,以应对该技术带来的挑战和机遇。
人工智能的应用取得了快速进展,已经给医疗行业和患者带来了好处。然而,这些应用程序在未来的改进方面具有更大的潜力。
为了确保人工智能的安全、合乎道德的实施和使用,各国政府正在创建一个全面的法律框架,以在潜在风险和收益之间取得平衡。
欧洲药品管理局(EMA)制定了2023-2028年人工智能在药品监管中的工作计划。欧洲议会和理事会最近还商定了世界上第一部监管人工智能的法律:《欧盟人工智能法案》。国际药品监管机构联盟(ICMRA)和世界卫生组织(WHO)也提出了其他建议和考虑。
这些发展特别关注医疗保健和医疗设备,反映出人们越来越认识到,需要明确的监管框架来确保人工智能的安全和道德使用。

AI在制药领域的应用
当我们在制药业谈论人工智能时,我们通常指的是一种技术,一个模型,或者一个集成到计算机系统中的算法。它使人工智能能够学习和推理数据,以便它能够执行自动化任务,做出决定和预测,而不需要人类对每一个步骤进行明确的编程。
这种能力隐藏在机器学习(ML)、自然语言处理(NLP)、计算机视觉、会话智能和神经网络等现象背后。
ML 指的是机器从数据中学习并随着时间的推移提高其性能,而 NLP 指的是计算机以与人类相同的方式理解文本和口语单词的能力。
借助深度学习 (DL)(ML 的一个子集),AI 系统能够识别模式、预测结果并根据不断变化的条件调整其行为。
随着云计算等基础设施的进步,以及硬件和软件技术、 DL 模型和大数据的增长,生命科学领域可获得的信息比以往任何时候都多。凭借其先进的算法,人工智能正在迅速革新医疗保健行业。
每一个监管机构都越来越认识到人工智能在生命科学中发挥的关键作用。它正在彻底改革公共卫生、临床实践、研究、药物开发、疾病监测和整个行业管理的各个方面。人工智能推动创新,提高患者疗效。
尽管人工智能受到赞誉,但是在制药领域,人工智能的偏见、隐私和安全性也引起了争议。
在一项题为“人工智能在医疗保健”的研究中,欧洲议会研究服务中心的科学预见部门(STOA)分析了它的应用、风险和机会,以及伦理和社会影响。
该研究强调,制药中的人工智能可用于自动化重复性任务,并帮助医生诊断和治疗疾病。但人工智能也存在风险:人工智能错误、生物医学人工智能工具的滥用、人工智能偏见、人工智能缺乏透明度、数据隐私和安全问题、人工智能问责制的差距以及人工智能实施的障碍。
例如,生物识别和面部识别技术需要复杂的人工智能算法来处理它们所需的大量信息。这项技术引起了人们对隐私和基本人权的担忧,有许多道德问题需要考虑。
用于健康的人工智能技术的设计、开发和部署也必须考虑伦理考虑和人权。
因此,有必要制定监管机制,以确保私营组织对那些可能从人工智能产品和服务中受益的人负责并做出回应,并确保透明度。

AI在生命科学行业的潜在应用
人工智能正在以多种方式彻底改变生命科学行业,从药物发现和开发到个性化医疗和疾病诊断。
根据 Definitive Healthcare 在2023 年对 86 家生物制药和医疗器械公司领导者进行的一项调查显示。
“到 2028 年,全球人工智能在生命科学市场的规模预计将达到 70.9 亿美元,复合年增长率 (CAGR) 为 25.23 % ,50 家最大的制药公司中有一半已与人工智能公司达成合作伙伴关系或许可协议”。这凸显了生命科学行业对人工智能的巨大兴趣和投资。
人工智能有潜力提高效率、速度、准确性和患者治疗结果。生命科学行业具有人工智能的多种潜在应用(瑞士安永,2023):
-
药物发现
-
个性化医疗
-
医学影像
-
临床试验设计
-
医学写作
-
需求预测
-
智能广告
-
智能供应商采购
-
制造优化
-
支持 SOP

现状及法规
人工智能法规和政策仍在制定中,下列为已经实现的一些主要里程碑。
全球:
2019年5月,经济合作与发展组织(OECD)通过了《OECD人工智能原则》(以下简称“建议书”)。
作为该文件目标的一部分,它旨在通过对值得信赖的人工智能的负责任管理以及尊重人权和民主价值观来促进人工智能的创新和信任。
2021 年 6 月,世卫组织发布了关于健康人工智能的道德和治理指南。
它概述了六项共识原则,以确保人工智能造福人类,并确定了道德挑战和风险。该指南向参与设计、开发、使用和监管人工智能健康技术的政策制定者、人工智能开发人员和设计人员以及医疗保健提供者介绍了初步知识。
2023 年 10 月,世卫组织发布了一份关于人工智能促进健康的监管考虑的新出版物。
该出版物探讨了人工智能在医疗保健和治疗开发中的开发和使用的监管和健康技术评估概念以及良好实践。
欧洲EMA:
2021年4月,欧盟发布了第一份《人工智能法案》提案(“欧盟人工智能法案”)。这是第一个针对人工智能制定统一规则的法规。
2023 年 7 月,作为 2022-2025 年大数据工作计划的一部分,欧洲药品管理局 (EMA) 大数据指导小组发布了一份关于人工智能在医药产品生命周期中使用的反思论文草案,概述了当前关于人工智能如何在医药产品生命周期中使用的思考论文。
人工智能可以帮助人类和动物开发、调节和使用安全有效的药物。通过这篇论文,EMA 与开发商、学者和其他监管机构展开对话,确保患者和动物能够从这些创新中受益。根据 EMA 的说法,人工智能的使用应始终遵守现行法律、考虑道德并尊重基本权利。(欧洲药品管理局,2023 年)。
2023 年 12 月,关于人工智能反思论文(RP)的公众咨询结束,制定指南的过程开始,包括是否需要多个指南。
2023 年 12 月,EMA 和药品机构负责人 (HMA) 发布了 2023-2028 年人工智能工作计划。
该计划旨在创建一个利用人工智能能力的监管体系,最大限度地发挥人工智能的优势,同时确保充分探索不确定性并降低风险。还指出,对 EMA 人工智能反思论文收到的评论将指导人工智能在药物生命周期中的使用的开发和评估。
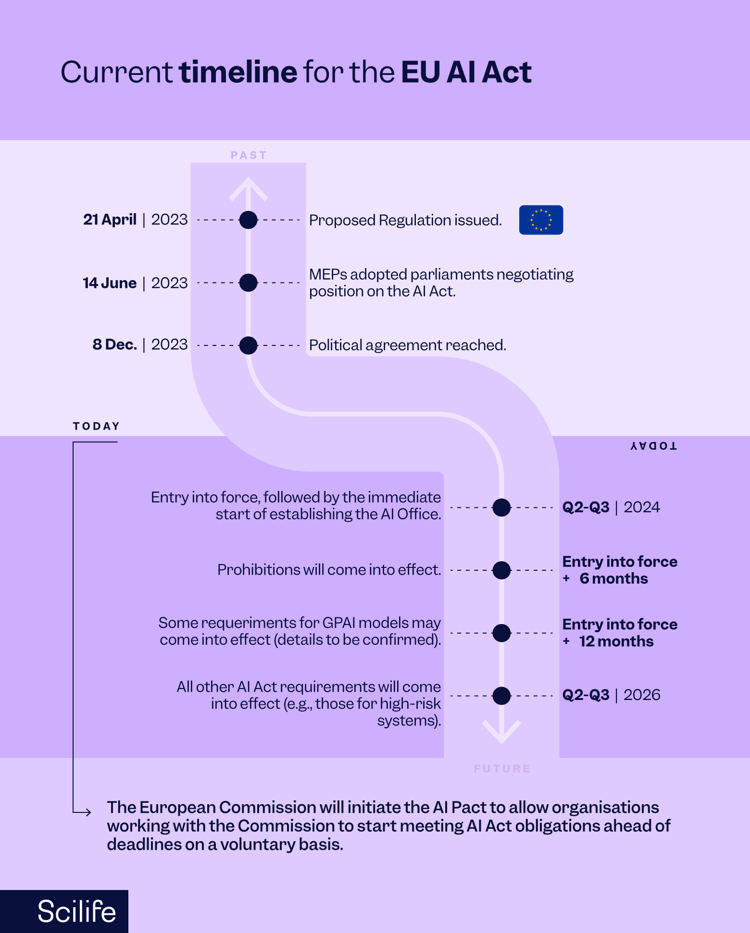
最后,2023年12月,欧洲议会和理事会就欧盟人工智能法案(“欧盟人工智能法案”)达成政治协议,这是世界上第一个监管人工智能的综合法律框架。
为了促进信任并确保人工智能系统“安全”并“尊重基本权利和欧盟价值观”,该法案规范整个欧盟的人工智能系统并鼓励人工智能投资。合并文本最终确定后,欧盟人工智能法案的大部分条款将在生效两年后适用。请参阅议会的新闻稿。
美国FDA:
FDA 致力于确保药物安全有效,同时促进药物开发创新,目前还没有适用的具体监管指南。然而,FDA 已邀请公众对已经发表的讨论文件发表评论,他们还与利益相关者合作,以更好地了解基于人工智能的技术对药物和医疗设备开发的影响,该机构计划在不久的将来敲定其监管框架。
2019 年 1 月,FDA 发布了开发软件预认证计划: 一个工作模式,为那些表现出强大的质量和卓越文化的制造商提供的基于软件的医疗设备提供更加简化和高效的监管。
2019 年 4 月,FDA 发布了一份讨论文件“拟议的基于人工智能/机器学习 (AI/ML) 的软件作为医疗器械 (SaMD) 修改的监管框架”,描述了 FDA 的方法对人工智能和机器学习驱动的软件修改进行上市前审查。
2021年1月,FDA发布了基于人工智能/机器学习(AI/ML)的软件作为医疗器械(SaMD)行动计划。FDA承诺支持医疗器械软件和其他技术监管方面的创新工作,例如人工智能/机器学习。在该计划中,FDA 概述了五个目标:
-
为基于 AI/ML 的SaMD量身定制的监管框架
-
良好的机器学习实践 (GMLP)
-
以患者为中心的方法,为用户提供透明度
-
与算法偏差和鲁棒性相关的监管科学方法
-
实际性能 (RWP)
FDA 在 2023 年发布了两篇关于人工智能使用的讨论文件,预计 FDA 在制定未来法规时将考虑此类意见。
-
第一篇论文《药物和生物制品开发中的人工智能和机器学习》旨在激发制药公司、伦理学家、学术界、患者以及全球监管机构和其他当局等感兴趣的各方之间关于人工智能/机器学习的潜在用途的讨论药物和生物开发,以及用于这些治疗的医疗设备的开发。本文还讨论了解决与 AI/ML 相关的可能问题和风险的方法。
-
FDA 的第二篇论文《药品制造中的人工智能》寻求公众对适用于批准使用人工智能技术制造的药品的监管要求的反馈。

人工智能工作计划
2023 年 12 月,EMA 和 HMA在欧洲药品监管网络 (EMRN) 中制定了2023-2028 年人工智能多年工作计划。
该计划的制定是为了负责任地促进人工智能在制药和医疗器械行业的使用。这些举措包括出于内部监管目的实施和监控人工智能、增强全网络分析能力以及与国际和欧盟机构合作。
为了确保患者的安全,欧盟致力于有效和负责任地监管人工智能,强调利益相关者沟通、研究重点和指导原则。
它表明欧盟致力于在生命科学领域维护人工智能的道德和负责任的使用。
到 2028 年,该工作计划将通过解决四个关键维度来管理人工智能活动:
1.指导、政策和产品支持:
-
到 2024 年第三季度,将启动《人工智能法案》生效的准备工作。
-
到 2024 年第四季度,将创建一个人工智能观察站,以监测人工智能的影响以及新颖系统和方法的出现。
2.工具和技术:
-
到 2024 年第一季度,监管机构预计将为 LMRN 网络推出知识挖掘工具。
-
监管机构还预计在 2024 年第三季度完成对网络使用人工智能分析数据的能力的调查。
-
到 2024 年第四季度,将发布网络工具政策,以促进开放和协作的人工智能开发。
3.协作和变革管理:
监管机构希望与其他合作伙伴和利益相关者合作:欧盟机构、国际合作伙伴、人工智能虚拟社区、人工智能、医疗设备和学术界的合作伙伴专家。
4.实验:
-
2024 年第一季度,实验周期将开始。
-
从 2024 年第二季度到 2026 年,计划制定供内部使用的负责任人工智能的内部指导原则,并在数字孪生等领域进行技术深入探讨。
-
到 2025 年第二季度,将发布网络研究重点路线图。
-
到 2027 年第二季度,研究重点将进行修订。

AI在生命科学领域的未来:展望
在不久的将来,我们预计将会看到更多关于人工智能使用的指南和法规,必须对其道德和负责任的使用进行有效监管,以确保患者安全。
人工智能的快速部署也带来了重大挑战,包括需要解决与复杂人工智能技术的理解、人工智能的道德和负责任使用相关的问题,以及人工智能决策过程中可能缺乏透明度的问题。
为了让人工智能取得成功并为社会带来好处,政府、组织和专家必须共同努力。
专家建议采取整体方法,解决预期用途、持续学习、人工干预和培训模型等问题。此外,整个社区应努力实现共同理解和相互学习。
人工智能 (AI) 的集成在生命科学领域既带来了希望,也带来了挑战。随着监管框架的发展和行业领导者解决道德问题,一场变革之旅正在发生。
关键要点是:
- 在全球努力确保安全和道德实施的推动下,生命科学领域的人工智能监管正在迅速发展。
- 尽管人工智能具有彻底改变医疗保健的潜力,但它引起了偏见和隐私等问题,强调了道德考虑和透明度的必要性。
行业领导者正在投资人工智能合作伙伴关系,强调其在提高效率和患者治疗效果方面的巨大增长潜力。 - 监管机构、行业利益相关者和专家之间的合作对于制定未来的人工智能政策和指南至关重要。
- 通过有效监管人工智能并与其他利益相关者合作,我们可以确保患者安全得到维护并维持道德标准。







 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


