在近日举行的2023年美国癌症研究协会(AACR)年会上,先声药业旗下肿瘤领域创新药公司先声再明8项研究在大会上展示,其中包括2项大会现场口头报告及6项研究壁报,涉及SMARCA2、CBL-b、Polθ、SOS1、MUC17、USP1等多个新型靶点,以及靶向蛋白降解、突变融合蛋白、双特异性T细胞衔接器等新型技术。下面我们将着重介绍这两项口头报告的研究成果。
口头报告一:Cbl-bi对抗抑制性免疫微环境,或可让PD-1更有效
据先声再明首席科学官Tamas Oravecz博士介绍,E3泛素连接酶CBL-b(Casitas B细胞淋巴瘤蛋白b)在多种免疫细胞内表达,通过促进泛素化作用,导致下游信号蛋白(如Vav1,PLCγ)降解,负向调节免疫功能。Cbl-b敲除的小鼠对移植瘤具有抵抗性。因此,Cbl-b有望成为一种新型细胞内免疫检查点药物靶点。
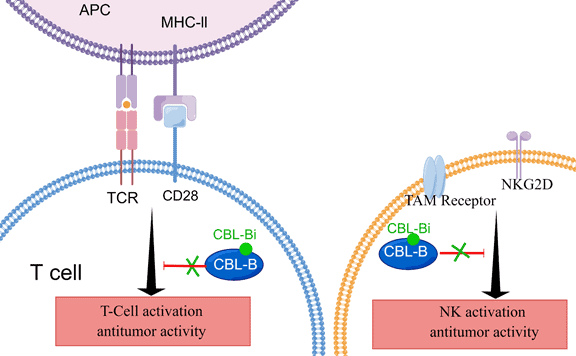
图片来源:先声药业提供
先声再明对一组自研的Cbl-b抑制剂新型分子进行了临床前鉴定,进一步确定了若干高亲和力分子,其对CBL-b的选择性比c-CBL高10倍,能够强力抑制Cbl-b。在不同细胞系(Jurkat T细胞、小鼠脾细胞、人类外周血单核细胞等)体外研究中,这些CBL-b抑制剂能显著提升免疫细胞的激活,同时增强了白介素2(IL-2)的分泌,以及引发了多种细胞因子反应。RNA测序分析显示,CBL-b抑制剂上调了多种免疫相关基因并增强了抗肿瘤免疫反应。而前列腺素E2(PGE2)引起的免疫抑制性反应可被CBL-b抑制剂阻断,提示CBL-b抑制剂对免疫抑制性微环境有对抗作用。
在动物体内研究中,同样观察到CBL-b抑制剂提升小鼠的IL-2和γ干扰素水平,以及对肿瘤生长的抑制作用,并且与PD-1抑制剂具有协同效应。相关结果表明,这一组新型分子有成为抗肿瘤治疗候选新药的潜力,值得进一步探索。
口头报告二:针对新型“合成致死”靶点的蛋白降解剂
先声再明副总裁李正涛博士报告了“合成致死”通路新分子——SMARCA2蛋白降解剂SCR-9140的临床前数据。该分子的作用机制涉及了对细胞染色质重塑和DNA修复极为重要的蛋白复合物SWI/SNF,其催化功能由两个ATP酶——SMARCA2或SMARCA4承担。不少恶性肿瘤会发生SMARCA4缺失突变,而大多数健康细胞不具有这种突变,因此SMARCA2成为此类肿瘤的“合成致死”靶点,即抑制SMARCA2有望精准杀死肿瘤细胞,但对正常细胞伤害较小。

图片来源:先声药业提供
体外研究显示,SCR-9140对SMARCA2的选择性相比SMARCA4的选择性高100倍,并在4小时内可以快速降解超过90%的SMARCA2蛋白。这种选择性降解能力在小鼠、狗、猴和人类细胞系(PBMC)中都得到了验证。而在具有SMARCA4缺失的多种恶性肿瘤细胞系中,SCR-9140有效降解SMARCA2的同时对细胞增殖有显著抑制作用。此外,SCR-9140对WI-38(人肺成纤维细胞)、THLE-2(人肝细胞)和人PBMC等非恶性细胞表现出弱细胞毒性,使其具有更大的治疗窗口。
在体内移植瘤模型研究中显示,SCR-9140有效抑制非小细胞肺癌的肿瘤生长,并与SMARCA2的降解密切相关。相关剂量并未影响动物体重,提示其安全性较好。综合而言,SCR-9140在体外和体内均显示出高效的SMARCA2选择性降解力,以及诱导 SMARCA4缺失细胞的“合成致死”能力,而对正常细胞较为安全。
来源:医药观澜






 ดูบอลสด
Very well presented. Every quote was awesome and thanks for sharing the content. Keep sharing and keep motivating others.
ดูบอลสด
Very well presented. Every quote was awesome and thanks for sharing the content. Keep sharing and keep motivating others.



