
点击蓝字 关注我们

微末生物
Nanomega BioAI
来自加州大学洛杉矶分校(UCLA)的周正洪教授等研究人员在《Nature》杂志上发表了题为“ A unified mechanism for intron and exon definition and back-splicing”的论文,揭示了酵母剪接体E复合体的冷冻电镜结构。这一结构启发研究人员提出并验证了“将内含子识别、外显子识别、以及反向剪接(back-splicing)机制进行统一”的模型,对理解真核生物pre-mRNA剪接的起始过程有着重要意义。
最后一块拼图:困境,缺憾与未解之谜
在接触分子生物学时,你或许听说过发生在真核细胞中的“RNA剪接”过程(图1)。在经典的分子生物学理论【中心法则】中,DNA中包含的遗传信息要先转录成为mRNA,然后再翻译成蛋白质。从酿酒酵母(S.cerevisiae)到人类(H.sapiens),大量真核生物基因组上转录出的前体mRNA(pre-mRNA)都包括外显子(Exon)和内含子(Intron)两部分,而大多数情况下仅有外显子可以被翻译为目标蛋白质。这些pre-mRNA需要经历一个名为“剪接”的步骤,才能将其中的内含子去除,将外显子拼接在一起,从而让中心法则的信息流顺利进入合成蛋白质的翻译环节。
如何精准地从pre-mRNA中去除内含子?这个过程由一种被称为剪接体(spliceosome)的大而动态的RNA-蛋白质复合物催化和控制,其中包含了5个小的核糖核蛋白颗粒 (snRNPs,包含snRNA及其他组件蛋白)和几十个蛋白质因子,并从头开始组装在pre-mRNA底物上。正确识别内含子与外显子是pre-mRNA剪接的第一步。在分子生物学上,这一步骤由pre-mRNA中的三个保守位置(图1),即5′-SS(GU)、BPS(A)和3′-SS(AG)决定,并由剪接体的组件特异性识别。在组装起始后,剪接体通过部件的增补和构象变化有序完成两步酯化反应,最终形成成熟的mRNA。
pre-mRNA剪接的起始是真核生物基因表达的关键步骤。当剪接相关的识别位点发生突变,或剪接错误地发生在其它符合剪接位点特征的干扰性碱基上,就会导致外显子缺失或内含子保留,进而引起基因表达异常、蛋白质功能的改变、或产生具备其他功能的小RNA片段。剪接符合体的正确起始及其后正确、有序的运作关系到大量细胞内蛋白的正确表达,和细胞周期、细胞命运乃至癌症的发生息息相关。
在过去的几年里,结构生物学家们在不断的钻研与探索中解析了真核生物剪接体从A,pre-B,B一直到P以及ILS的其他各种复合体结构(图2),为我们展示了关于剪接体运作的大量细节。然而,这一剪接环路的拼图中还缺乏最重要的一块——我们仍未阐明作为剪接反应起始的“E复合体”的三位结构。
E复合体结构长期没有得到解析的情况并非是科学家刻意为之。因发现RNA剪接而获1993年诺贝尔生理学与医学奖的菲利普·夏普(Phillip Allen Sharp)教授就曾评价说:“我之前不确定我们是否真的能‘看到’在活性状态下的剪接体结构,因为构成它的蛋白和RNA是如此多样并复杂。”而2009年诺贝尔生理学与医学奖得主杰克·肖斯德克(Jack Szostak)也指出“相较于核糖体,在原子分辨率解析剪接体的结构更为困难,因为剪接体由一系列不同蛋白质和蛋白核酸复合物组成,组分和构象都是高度复杂和动态的。”在E复合体中,由于pre-mRNA上的蛋白质和结构性的RNA组分较少,所形成的整体结构和其他复合体更加缺乏稳定性,也更加难以得到稳定的、高分辨率的结构。这使其成为了在整个剪接过程中唯一没有得到三维结构的“最后一块拼图”。
这一技术上的困难所带来的缺憾,在剪接体的分子生物学逻辑中留下了许多未解之谜。仅靠pre-mRNA上相互交替的GU-A-AG位点的分割,剪接体要如何区分自己即将删除的一段是GU与A之间的内含子,还是A和下一个GU之间的外显子?为何前人报道酿酒酵母中剪接体以跨内含子的识别(intron definition;IDC)为主,而到脊椎动物剪接体中变成了跨外显子(exon definition;EDC)为主?脊椎动物如何将横跨外显子形成的EDC转换为能够顺利剪接内含子的IDC复合物?
另外,circRNA,这一在进化上古老而保守,在细胞的正常生命活动乃至肿瘤发生与治疗的过程中扮演了重要角色的小RNA分子,被报道是通过“反向剪接”(back splicing)产生的,也就是从前体RNA上以环状形式将一部分外显子剪接下来。什么决定了反向剪接的选择性起始?
细胞怎么知道自己识别的是外显子还是内含子?细胞如何决定什么时候剪掉外显子,什么时候剪掉内含子?这些问题的背后一定隐藏着不为人知的巧妙机制。
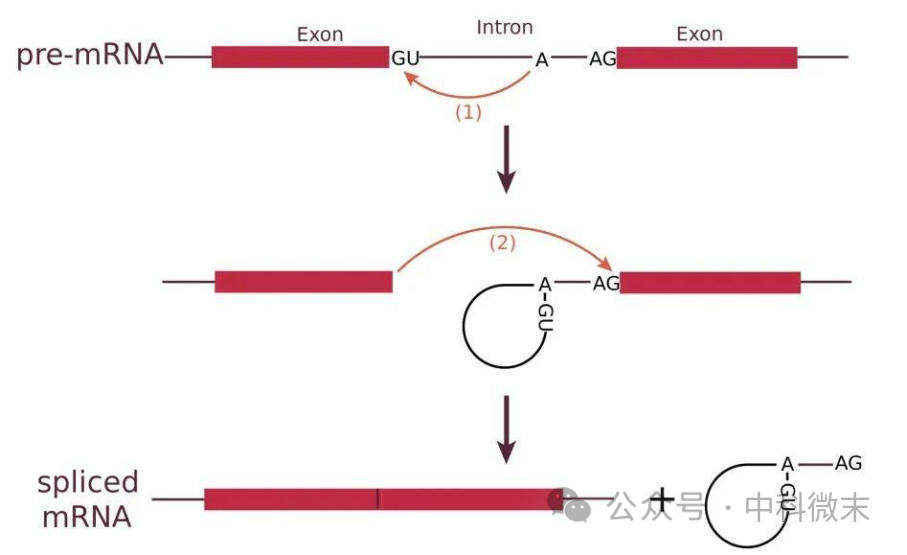
图1 剪接反应的过程。两个红色部分表示外显子,中间的线段表示内含子。红色箭头表示两次亲核转酯反应,这是剪接反应的化学本质
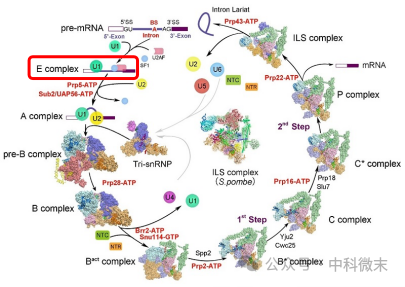
图2 启发:挑战剪接体E复合物的结构解析
“明知山有虎,偏向虎山行”,即使E-complex结构解析的困难人尽皆知,周正洪教授团队仍然决定进行尝试。团队首先在体外搭建了酿酒酵母ACT1的pre-mRNA的剪接体E-complex结构。在发现这一结构在一些关键细节上有些不尽人意后,他们又在加入了交联剂(维持-增强结构稳定性)的情况下解析了UBC3的pre-mRNA结构。和之前使用的ACT1 mRNA分子不同的是,UBC3 mRNA分子在5’端拥有RNA帽(一种常见的mRNA 5’端修饰,保证mRNA的稳定性),并且其内含子部分不形成分子内的二级发夹结构。
结合这两个复合物的结构特征,周正洪教授团队首先分析出了E-complex中的【RNA 5’端帽结合蛋白NCBP】和【内含子内RNA发夹结构】在起始剪接体形成中起促进作用的重要结论(图3)。
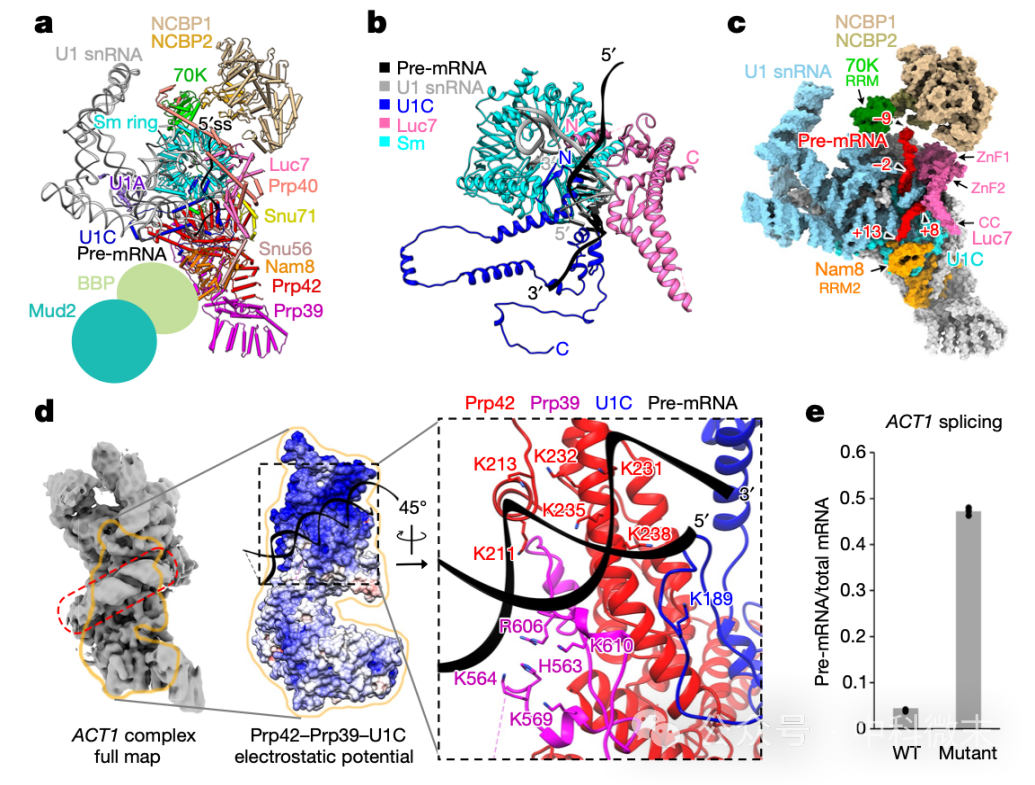
图3 根据三维结构分析能够得到许多重要结论。
(图a-c:NCBP在U1snRNP的招募过程中可能起到重要作用。
图d-e:ACT1 complex中内含子的二级结构和多个蛋白质结构域靠离子键结合,并在剪接起始过程中起重要作用)
同时,在结构解析中,有一项发现引起了研究人员的注意。之前的生化研究表明,在E-complex中,Prp40蛋白能够同时与【识别5’ss位点的U1snRNP部分】和【识别BPS位点的BBP-Mud2复合物】相互作用,起到“连接桥”的作用。在对现有的E-complex进行结构分析时,研究人员发现Prp40的结构密度呈现出“回旋镖”样的形态(图4,粉色)。但是,Prp40蛋白中仅有接近70K RRM蛋白(绿色)的FF4-6部分能够被确定下来,因为这一部分结构相对稳定,并与较为稳定的5’ss部分的U1snRNP结构十分接近;除此之外,更加靠近蛋白N端的FF1-3部分和WW1-2部分都无法获取稳定的三维结构。
也就是说,越靠近结合BBP蛋白的WW1-2区域,Prp40的可变动性就越强,这一蛋白结构域越难以呈现出确定的形态。在UBC3剪接复合体(图4)的三维结构中,完全无法捕捉到BBP-Mud2复合体的密度结构;而在内含子中具有发夹结构的ACT1 mRNA中,研究人员在双螺旋发夹的附近发现了一大团低密度结构。由于体外搭建剪接体结构的过程很好地排除了U2snRNP等其他分子参与剪接体组装的可能,研究人员结合多种手段,最终将这一部分确定为BBP-Mud2复合体。
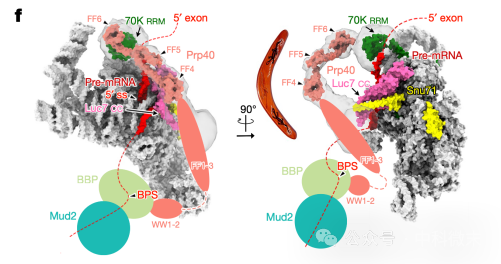
图4 Prp40在UBC3 mRNA剪接复合体上的结构解析
U1“大本营”和BBP-Mud2复合体之间连接的灵活性代表了5’ SS和BPS两个关键识别位点间连接的灵活性。二者之间的联系并不是确定的、刚性的,而是有着相当的活动空间。这为研究人员解答剪接过程如何识别外显子和内含子的问题提供了重要的启发。
理论分析预测配合生化实验验证揭开谜题
“The architecture of the E complex … …,suggests that the same E complex can form across an exon.”
这种结构上的灵活性表明,剪接复合体完全能够跨越外显子形成——复合体能够通过结合前一个内含子的BPS(图5b,红色)和后一个内含子的5’端SS(图5b,粉色)形成跨外显子的结构,而无需遵循跨越内含子的经典结构(图5a)。计算机的模拟表明,在跨外显子的连接方式中,在E-complex之后形成下一步的A-complex时,仅仅需要28nt的核苷酸长度就可以满足连接U1snRNP和U2snRNP的复合物结构形成。这一要求并不高,因为很多外显子也可以提供28nt以上的间隔长度,确保U1和U2之间不发生结构干涉。而在E-complex中,这一要求实际上更低。
但是,如果考虑到后面pre-B complex中发生的Tri-snRNP加入,导致复合物之间的角度打开和可能的空间位阻,我们就会发现,跨外显子形成的剪接体有三种命运——
-
外显子区段相对较短(图5b):无法提供足够的角度,或挡开了Tri-snRNP,因而无法形成稳定的、跨越了外显子的pre-B complex,导致复合物发生重排,重新形成经典的跨内含子复合物(图5a)。
-
外显子区段够长,而且没有其他干扰因素(图5c):能够形成稳定的、跨越了外显子的pre-B complex,导致pre-mRNA中被跨越的外显子(E2)被剪切下来,生成一个由E2外显子组成的circRNA。
-
如果外显子区段够长,但被其他分子因素干扰:复合物仍然会发生重排,导致复合物重新回到经典的跨内含子形成的状态(也就是说,外显子长度在内含子/外显子选择中不是唯一的决定因素)。
这是一个完整而精美的“外显子长度决定剪接目标选择”的模型。
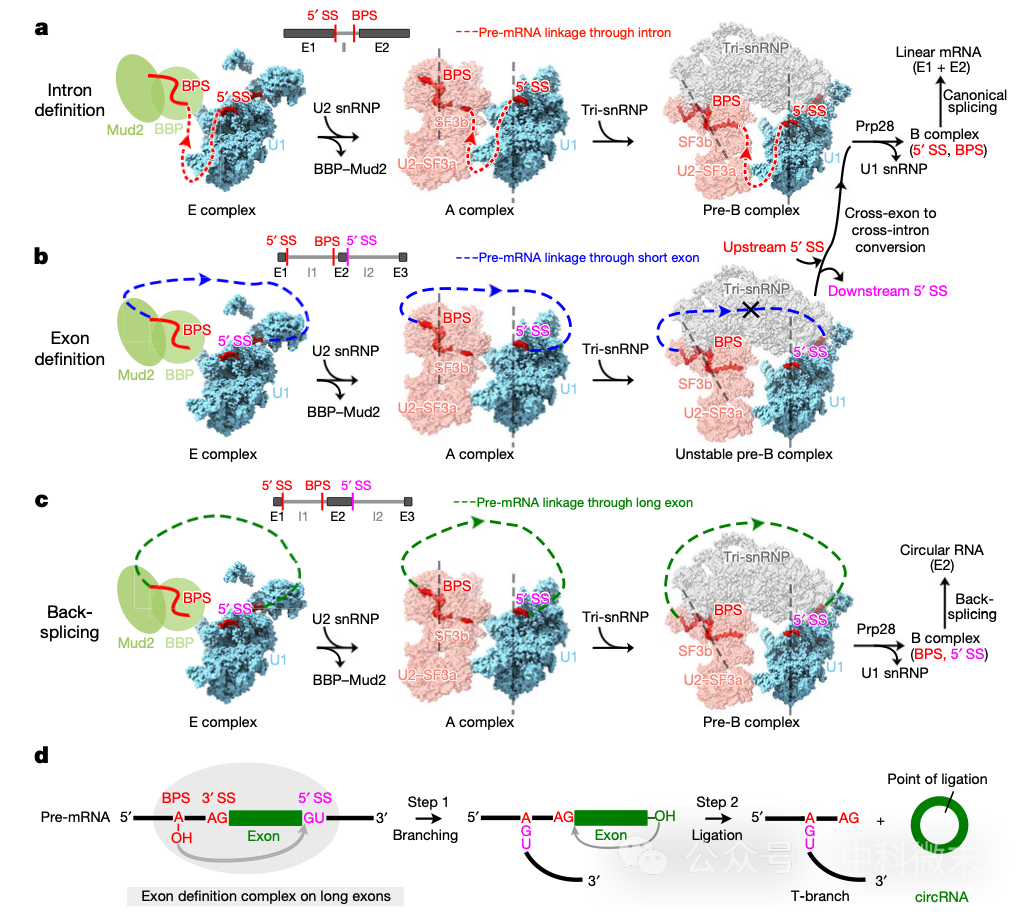
图5 剪接体起始的可能形式(a 跨内含子的经典模式;b 在外显子不够长的情况下形成的跨外显子结构会重排成跨内含子模式;c-d 在外显子足够长的情况下维持跨外显子结构,剪掉的外显子形成环状的circRNA)
在意识到这一点后,研究人员设计了精妙的生化实验,利用RT-PCR等技术,通过体内表达突变体的方式证明了【外显子识别也能够在酵母中发生】,并通过分离纯化剪接体中间体和追踪体外合成的剪接体的方式证明了【在足够长的外显子上,跨外显子形成的剪接复合物能够催化“反向剪接”并生成circRNA】。
至此,“真核生物如何在剪接过程中区分其外显子与内含子”的关键问题得到了解答。答案的核心就在于外显子的长度——在脊椎动物细胞中,外显子足够多,足够长,因此优先形成了跨外显子的结构;在酵母细胞中,外显子数量较少,长度较短,因此以跨内含子的剪接体结构为主导。但这不意味着在酿酒酵母中就无法形成跨外显子的复合物;只要给定合适的pre-mRNA,在酵母中也可以捕捉到跨外显子剪接体的形成。
总的来说,这一简单而精妙的模型为从酵母到脊椎动物横跨了整个真核生物界的,“同样的剪接体如何分别介导内含子识别、外显子识别和反向剪接体起始”的谜题提供了答案。
纵观这一分子生物学关键问题的解答过程,我们会发现,课题组使用冷冻电镜对ACT1和UBC3剪接复合物的结构解析在谜题的回答中起到了重要作用。正是通过使用冷冻电镜解析了这两种不同mRNA的E-complex结构,课题组才能够抓住“起连接作用的Prp40蛋白具有灵活性”这一关键特征,从而提出“剪接体通过外显子长度选择跨内含子/外显子形成”的模型。尽管冷冻电镜在作用于高度柔性的结构域时并没有在每一个部分都得到非常细致的结构,但课题组通过结合两种不同的mRNA的解析结果,抓住了其中的关键线索,从而推断出了精妙的机制模型,并通过体内和体外的生化实验对其假设进行了验证,最终解开了这一悬而未决的分子生物学难题。
这一工作形象地说明,用冷冻电镜解析结构并不只是结构生物学研究的专利,而是能够帮助每一个分子生物学家推进项目的“得力助手”。随着冷冻电镜成像技术和结构预测技术的发展,对蛋白质结构的解析工作正在逐渐显示出其最核心、也是最有价值的地方。它并不是一个“隔世独立”的专门领域,而是正在演变为一种成熟而强大的、富含信息量的、有强烈启发性的分子生物学核心技术。
正如费曼曾说的那样:“回答许多基本的生物学问题非常简单:你只需直接观察事物本身!”周正洪教授团队为我们提供了一个使用冷冻电镜观察分子本身,并最终回答分子生物学问题的的经典范例——从结构解析所得的线索出发,结合理论分析和生化验证,最终阐明了关键的分子生物学问题。
目前,中科微末团队在生物大分子三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


