
点击蓝字 关注我们

微末生物
Nanomega BioAI
2020年的诺贝尔生理学或医学奖授予了哈维·阿尔特(Harvey J. Alter)、迈克尔·霍顿(Michael Houghton)和查尔斯·赖斯(Charles M. Rice)三位科学家,因为他们发现了丙型肝炎病毒(HCV),在对抗血源性肝炎、减少肝硬化和肝癌上做出了重大贡献。
丙型肝炎病毒(HCV)是一种感染人类的有包膜RNA病毒。它主要依靠血液传播(如输血),能够逃避人体的先天免疫和适应性免疫,并在70%的情况下会发展为慢性感染;如果不加以治疗,20%的患者会出现肝硬化,其中一部分可发展为肝癌。
每年全球超过7000万人感染此病,约40万患者因其死亡,也是肝脏移植手术发生的常见原因。而在未来几十年,有进展性慢性丙型肝炎的患者人口将显著增加。2006年,我国调查结果显示1~59岁人群HCV抗体阳性率为0.43%,感染者共计约1000万例。
作为一类广谱而低效的抗病毒制剂,人们曾经使用干扰素(IFN-α,一种抗病毒蛋白)作为治疗丙型肝炎的常规药物。然而,这一类药物虽然能控制丙肝感染,但却会为患者留下后遗症和复发隐患。在药物学领域的早期进展中,随着首个直接作用抗病毒药物(DAAs)获得许可,丙肝的针对性治疗可谓曙光初现;然而长期以来,缺乏合适的细胞培养系统一直是科学家们研究HCV的主要障碍。事实上,在21世纪初,人们还没有关于丙型肝炎病毒的直接结构信息。
在当时,根据已经获得的HCV结构信息,研究人员已经开发了多种抑制HCV蛋白的抗病毒药物,主要针对三种非结构性的HCV蛋白:处理病毒前体多聚蛋白所需的NS3-4A蛋白酶,调节RNA基因组复制和病毒组装的NS5A磷蛋白,以及催化基因组复制的病毒RNA依赖性RNA聚合酶(NS5B)。尽管如此,人们仍然希望对HCV的微观结构获得更深入的理解,通过了解丙型肝炎病毒如何与宿主相互作用,为丙肝的治疗和疫苗的研发提供更加有力的支持。这就需要对丙肝病毒颗粒的外壳部分(位于包膜之外的、由包膜内嵌蛋白E1和E2组成的蛋白壳层,图1)进行整体的结构解析,以探究其组织方式。
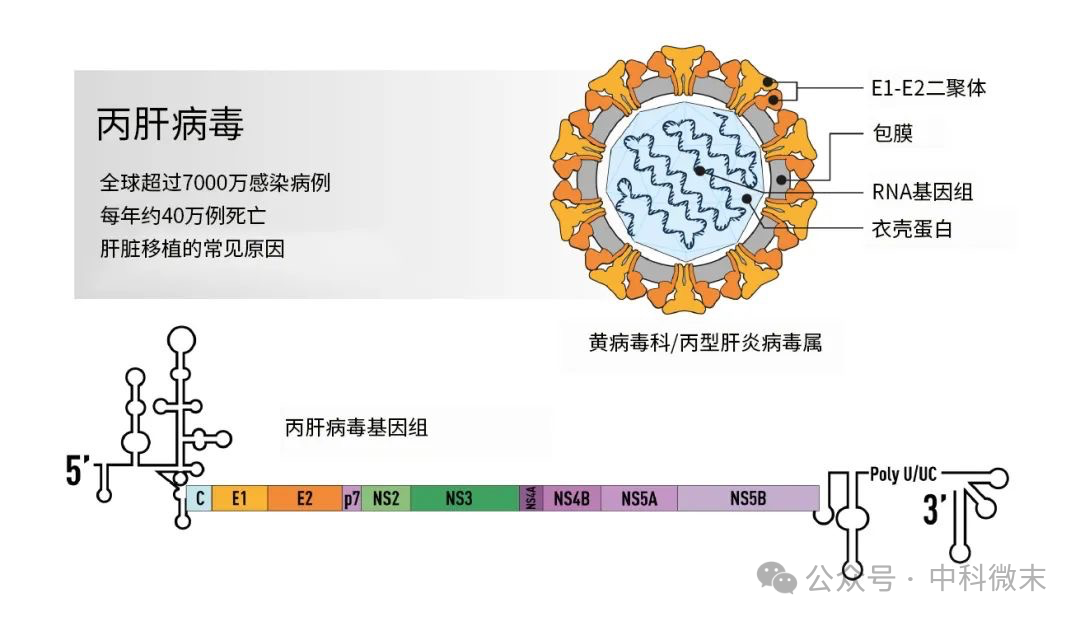
图1:丙型肝炎病毒颗粒结构,及其基因组结构(图源果壳网,原图来自诺贝尔奖官网)
在2007年,来自美国休斯顿德克萨斯大学医学院病理与检验医学系的周正洪教授团队及其合作者使用负染色电镜方法(negative-stain)和冷冻电镜成像技术(cryo-EM),探究了细胞培养中分离的HCV病毒粒子的形态结构和抗原特性,首次对HCV病毒颗粒整体进行了三维结构重构分析,为HCV组装和成熟的机制提供了重要见解。
该研究成功地从细胞培养中分离出HCV病毒粒子,并通过负染色制样技术,结合透射电子显微镜(TEM)和低温电镜获得了纯化的HCV病毒粒子的高分辨率微观图像。在电镜下,HCV病毒粒子的大小非常均匀,直径约为500 Å(图2)。
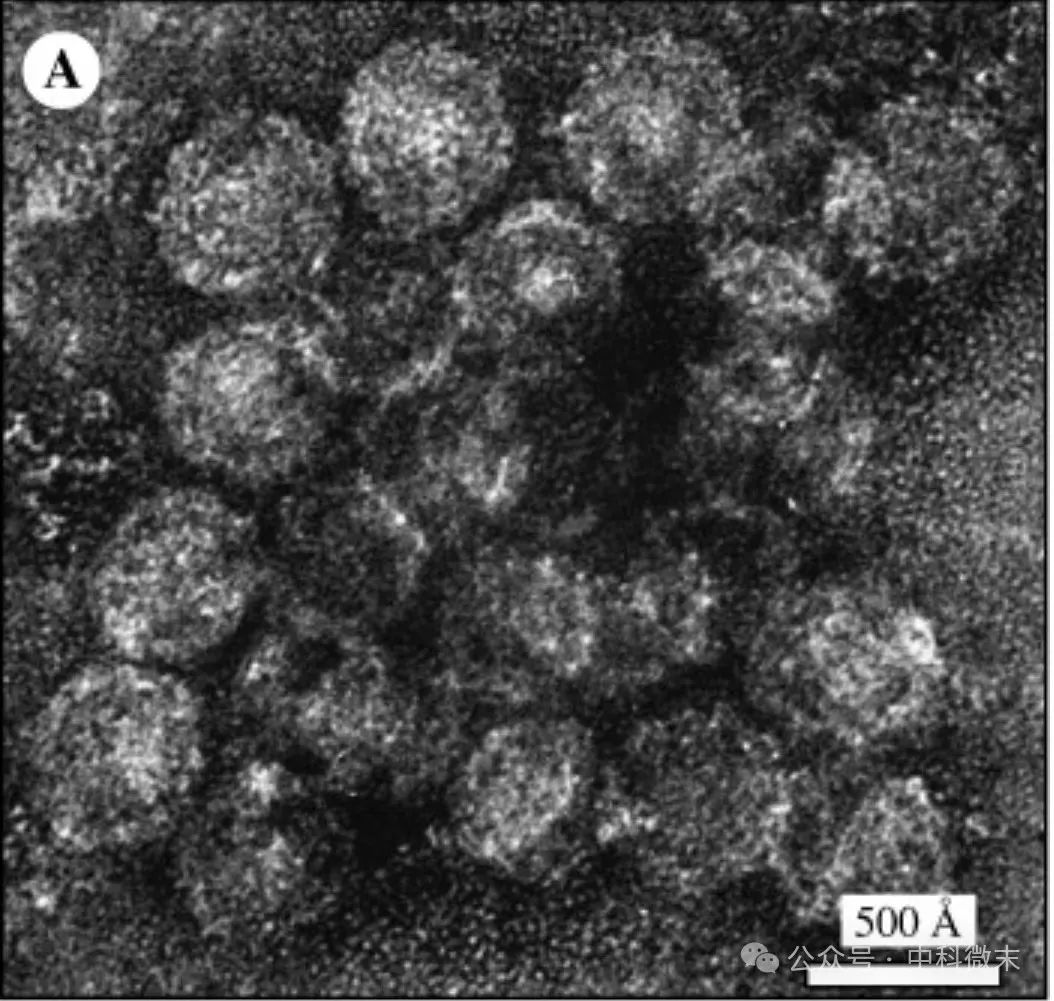
图2:负染色-透射电镜成像显示从培养细胞中纯化得到的HCV病毒颗粒具备较为一致的大小
由于足量的HCV粒子非常难以获得,研究人员采取了较为成熟的办法,在昆虫细胞系中生产了大量重组的类HCV粒子(HCV-like particles,HCV-LPs)。通过冷冻电镜,他们对含有最高浓度 HCV 结构蛋白的提取物成分进行冷冻电镜检查,发现其为表面光滑的球形颗粒,与野生型HCV病毒粒子和从HCV感染患者中分离的天然HCV病毒粒子形态一致。
因此,研究人员决定采用这种HCV-LPs进行后续的结构探究。他们随后用针对HCV-E1蛋白的单克隆抗体标记HCV-LPs来检测HCV的结构,观察到明显的颗粒聚集,证实了HCV-LP外层含有E1蛋白(图3),并且可能与E2复合物一起形成了HCV-LP的外层。
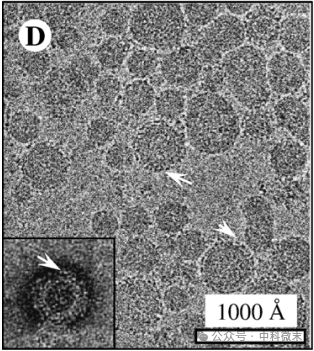
图3:使用冷冻电镜对结合E1单克隆抗体的HCV-LP粒子进行成像,可以清楚看到HCV-LP粒子的周围环绕了一圈密度(白色箭头),这就是结合在病毒衣壳上的E1蛋白抗体
在3D重建中发现,HCV-LP存在二十面体对称性,显示了带有表面压痕的光滑外壳(由E1和E2组成)和特征性的内部磷脂分子双层包膜结构(图4C),以及外壳上与黄病毒科其他成员类似的90个“鱼骨”形结构组件。在HCV-LP的外表面上,E1蛋白与E2蛋白密切相互作用,形成E1-E2异二聚体。两个E1-E2异源二聚体进一步组装成串联四聚体,构成HCV颗粒光滑外表面的基本结构(图4C黑色箭头)。E1-E2层之下是两个密度较低的层,间隔为40-45 Å,考虑为脂质双分子层(图4C红色箭头)。再往里则是衣壳蛋白(图4C蓝色箭头)。值得注意的是,HCV-LP病毒颗粒的E1-E2蛋白密度层和脂质双分子层之间存在清晰的界限,与双层膜外小叶之间的距离约为30 Å,表明HCV-LP和同属于黄病毒科的登革病毒(dengue virus)颗粒不同,在E蛋白和脂质双分子层之间缺乏M蛋白层。此外,HCV-LP的膜双分子层似乎受到其上的二十面体E1-E2蛋白层的影响,整体构造呈微多边形形状,而不是自由脂质囊泡的典型球形。
对结合了E1抗体的病毒颗粒的三维成像显示了与单纯病毒颗粒成像相似的结果。在图4E中,属于E1蛋白抗体的密度由粉红色显示。数字2,3,5表示了不同的对称轴。可以看出,结合E1蛋白的抗体主要集中在病毒表面3重对称轴的附近,5重对称轴的周围,以及在2重对称轴上沿线分布。这样的分布特征提示了E1蛋白在病毒外层的组织方式。
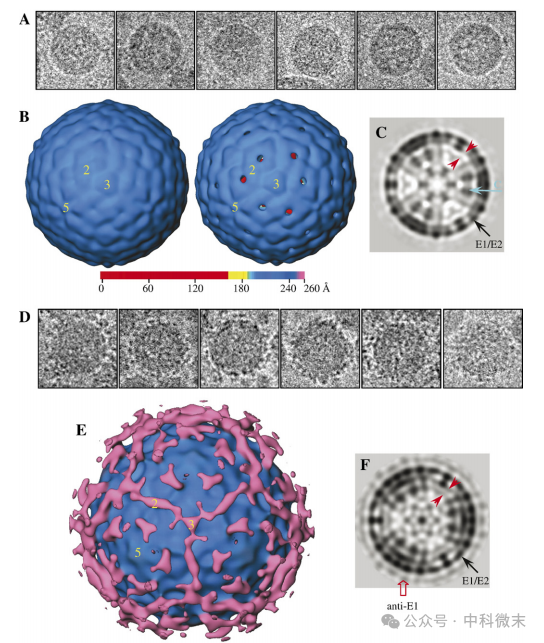
图4:HCV蛋白的冷冻电镜三维成像结果
与代表性的黄病毒——蜱传脑炎病毒(TBEV)相比,每个HCV的 E1-E2异二聚体类似于其E蛋白的单体,而HCV-LP中每两个E1-E2异二聚体构成的四聚体复合物在结构上都类似于黄病毒E蛋白的同二聚体(图5)。基于前人的HCV E2蛋白模型, HCV和黄病毒的基因比较、HCV- LP的三维重构结果、以及HCV-LP结合E1抗体的三维重建结果,研究人员提出了一个HCV外层蛋白的结构组织模型。其中,E1-E2四聚体作为外壳的基本结构,该结构的90个拷贝以类似于黄病毒E蛋白二聚体的方式排列,形成直径为500 Å的外壳。HCV的E2蛋白对应TBEV E蛋白的结构域I和II,E1蛋白则取代了结构域III。黄病毒的E蛋白具有免疫球蛋白样结构域III,在病毒表面呈现出一个小突起。HCV E1蛋白虽然在结构上取代了这个结构域III,但缺乏这样一个突出的区域。
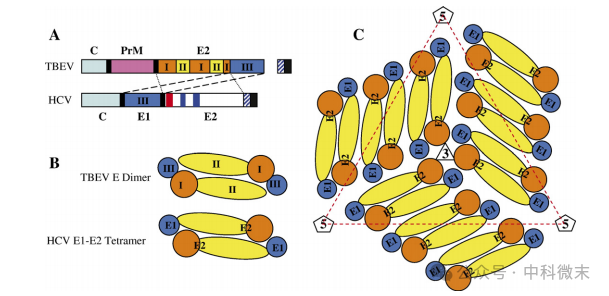
图5:将典型黄病毒的外层蛋白及其组织形式与HCV蛋白相对比
研究结果也表明,HCV的组装与黄病毒的组装大致相似,但具有一些独特的特征。在HCV的多聚蛋白的合成过程中或此后不久,在内质网中形成的HCV E1-E2异二聚体可能首先组装成未成熟的病毒颗粒。然后,异二聚体发生构象变化,暴露E2二聚结构域,诱导多个E1-E2异二聚体进一步组合起来,进行成熟HCV颗粒的外壳组装。与黄病毒不同的是,HCV表面蛋白的构象变化可能在没有蛋白水解/裂解的情况下发生,且表面的E1和E2蛋白在组装过程中保持密切的相互作用。而在典型的黄病毒中,只有E蛋白暴露在外表面,成熟的M蛋白埋在E蛋白层和脂质双分子层之间。
总的来讲,该研究提供了第一个丙肝病毒的粒子的三维模型,并获得了HCV E1外源性定位的直接结构证据,揭示了丙肝病毒和黄病毒在结构组织上的关键差异和相似之处。通过对该模型在更高分辨率水平上的研究,能够进一步了解HCV的病毒组装和生命周期、HCV结构蛋白之间的分子相互作用,探索宿主-丙型肝炎病毒相互作用的分子和细节。揭示这些结构及靶点之间的相互联系是确定HCV体内感染参数及其生理病理过程的关键,也是制定新治疗方法的关键,最终为寻找抗HCV的靶点提供新的方向。
21世纪初,HCV 在体外细胞中稳定复制的实现、以及 HCV 完整感染周期的揭晓,让丙肝药物的研发进入快车道。冷冻电镜的使用在较高分辨率上解析了这一重要病毒的三维结构,使得研究人员能够建立组成其外壳蛋白的分子模型,为HCV的研究与防治奠定了重要基础。时至今日,冷冻电镜的分辨率不断跃升,研究难度逐渐下降,在医学诊断、样品鉴定、药物研究等诸多方面展现出了强大的应用潜力。目前,中科微末团队在生物大分子三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流






 ดูบอลสด
Very well presented. Every quote was awesome and thanks for sharing the content. Keep sharing and keep motivating others.
ดูบอลสด
Very well presented. Every quote was awesome and thanks for sharing the content. Keep sharing and keep motivating others.



